
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия идеального газа
|
|
|
|
Теория теплоты. Термодинамика идеального газа
Уравнение состояния идеального газа
В процессе вывода соотношения (2.6) возникли еще две макроскопические характеристики системы многих частиц — давление P и объем V. Задание температуры, давления и объема определяет состояние системы частиц (тела). Эти величины называются параметрами состояния.
Давление P, объем V и температура, T не являются независимыми величинами. Соотношение, связывающее эти три параметра, вида f (P, V, T) = 0 называется уравнением состояния. Найдем уравнение состояния идеального газа. Подставляя в соотношение (2.6) выражение (2.3), получим
PV = N·kБ·T. (2.7)
Отметим универсальный характер полученного уравнения: в него не входят никакие величины, характерные для определенного газа, а только числа частиц. Отсюда следует, в частности, что при одинаковых давлении и температуре разные газы, занимающие равные объемы, содержат в них равные числа молекул. Этот закон был установлен ранее опытным путем Авогадро.
Перепишем уравнение состояния в терминах объема, приходящегося на единицу вещества — моль. Один моль — это количество вещества в граммах, численно равное его молекулярному весу. Например, 1 моль кислорода содержит 32 г вещества. Удобство этой единицы измерения состоит в том, что по определению в 1 моле любого вещества содержится одинаковое число молекул, называемое числом Авогадро NA. Оно равно 6·1023 молекул. Число молекул в объеме газа можно записать в виде:
N = ν· NA,
где v — число молей данного вещества в указанном объеме. В этих обозначениях уравнение состояния принимает вид:
PV = v · R · T. (2.8)
Величина R = kБNA называется газовой постоянной.Пусть при нагревании газа на 1 К объем, занимаемый 1 молем газа, изменился при неизменном давлении на Δ V. Представляя давление газа в виде P = F / S, а объем сосуда в виде Δ V =, видим, что величина P Δ V = F Δ h есть работа, произведенная газом при его расширении. Таким образом, физический смысл газовой постоянной состоит в том, что она численно равна работе, совершенной 1 молем газа при его нагревании на 1 К при постоянном давлении.
Внутренней энергией тела называют часть его полной энергии за вычетом кинетической энергии движения тела как целого и потенциальной энергии тела во внешнем поле. Таким образом, во внутреннюю энергию входят кинетическая энергия поступательного и вращательного движений молекул, потенциальная энергия их взаимодействия, энергия колебательного движения атомов в молекулах, а также энергия различных видов движения частиц в атомах.
В идеальном газе потенциальная энергия взаимодействия молекул пренебрежимо мала и внутренняя энергия равна сумме энергий отдельных молекул
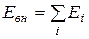 , (2.24)
, (2.24)
где Ei — энергия отдельной молекулы. До сих пор мы пользовались представлением о молекулах как о материальных точках. Кинетическая энергия молекул считалась совпадающей с энергией их поступательного движения, а средняя кинетическая энергия молекулы полагалась равной  . Эта энергия распределяется между тремя поступательными степенями свободы.
. Эта энергия распределяется между тремя поступательными степенями свободы.
Ввиду полной беспорядочности движения молекул в газе все направления перемещения молекулы равновероятны. Поэтому на каждую степень свободы поступательного движения приходится в среднем энергия
 .
.
Представление о молекулах как о материальных точках оправдывается только для одноатомных газов. В случае многоатомных газов нужно рассматривать молекулы как сложные системы, способные вращаться как целое, причем атомы в них могут совершать колебания вблизи своих положений равновесия. Общее число степеней свободы молекулы при этом увеличивается.
Вспомним, что числом степеней свободы механической системы называется количество независимых параметров, с помощью которых может быть задано положение системы. Так, положение материальной точки в пространстве определяется заданием значений трех ее координат. В соответствии с этим материальная точка имеет три степени свободы.
Положение абсолютно твердого тела можно определить, задав три координаты его центра инерции и три угла, характеризующие возможные повороты тела в пространстве. Таким образом, абсолютно твердое тело имеет шесть степеней свободы — три поступательных и три вращательных.
N материальных точек, не связанных между собой, имеют 3N степеней свободы. Поскольку положение в пространстве системы как целого точно так же, как и положение абсолютно твердого тела определяется шестью параметрами, упомянутыми выше, то число степеней свободы такой системы равно 3· N -6. Это число соответствует возможным смещениям точек относительно друг друга около своих положений равновесия. Такой тип движения называется колебательным. Значит, количество колебательных степеней свободы и есть 3· N -6.
Энергия молекул, состоящих из некоторого числа атомов, не жестко связанных друг с другом, будет теперь складываться из энергии поступательного движения, вращательной энергии и энергии колебаний
Ei = Eпоступ + Eвращ + Eколеб. (2.26)
Нет причин полагать, что поступательное движение является в какой-то мере выделенным по сравнению с вращательным или колебательным. Поэтому следует считать, что по-прежнему на каждую степень свободы молекулы приходится энергия, равная kT /2. Однако следует учесть особенность, связанную с колебательным движением. Средняя энергия колебательного движения складывается из средней кинетической энергии и равной ей средней потенциальной энергии. Поэтому на каждую колебательную степень свободы приходится энергия, в два раза большая, чем на поступательные или вращательные степени свободы. Следовательно, средняя энергия молекулы должна равняться:
< Ei > = i · k · T, (2.27)
где i — сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
i = iпоступ + iвращат + 2· iколеб. (2.28)
Внутренняя энергия на один моль идеального газа
 . (2.29)
. (2.29)
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 773; Нарушение авторских прав?; Мы поможем в написании вашей работы!