
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов I группы побочной подгруппы
|
|
|
|
I группа побочная подгруппа
1. Общая характеристика I группы побочной подгруппы
2. Нахождение в природе
3. Получение металлов I группы побочной подгруппы
4. Физические и химические свойства
5. Соединения меди
6. Серебро и его соединения
7. Золото
8. Применение
В состав I (11 по современной номенклатуре) группы побочной подгруппы входят медь Cu, серебро Ag, золото Au. Данные металлы называли «монетными металлами», потому что в древние времена их использовали как деньги, а потом чеканили из их сплавов монеты.
В основном состоянии атомы элементов I группы побочной подгруппы имеют электронную конфигурацию внешнего энергетического уровня – …(n–1)d10ns1, где n – главное квантовое число (номер периода). Для атомов элементов I группы побочной подгруппы характерны степени окисления +1, +2, +3. Максимальная степень окисления не соответствует номеру группы в короткопериодном варианте периодической системы Д.И. Менделеева. В водных растворах для меди характерна степень окисления +2, для серебра +1, для золота +3. Для атомов элементов I группы побочной подгруппы характерны следующие степени окисления: для меди – (0, +1, +2, (+3), (+4)); для серебра – (0, +1, (+2), (+3), (+4), (+5)); для золота – (–1, 0, +1, (+2), +3, (+5), (+7)).
Валентные электроны у атомов элементов I группы побочной подгруппы расположены на d- и s- орбиталях. Электронная конфигурация внешнего и предвнешнего энергетического уровня в основном состоянии напоминает электронную конфигурацию щелочных металлов, имеющих заполненную р-орбиталь и один электрон на s-орбитали внешнего энергетического уровня. Но, несмотря на сходство электронных конфигураций, химические свойства щелочных металлов и элементов I группы побочной подгруппы отличаются. Это объясняется тем, что заполненные электронами d-орбитали в атомах меди, серебра и золота слабее экранируют внешние s-электроны, чем р-орбитали. Поэтому у атомов меди, серебра и золота s-электрон внешнего энергетического уровня сильно связан с ядром (более высокие значения энергии ионизации по сравнению с щелочными металлами).
|
|
|
В табл. 1 представлены основные свойства I группы побочной подгруппы.
| Свойство | Cu | Ag | Au |
| Заряд ядра | |||
| Электронная конфигурация внешнего и предвнешнего энергетического уровня в основном состоянии | …3d104s1 | …4d105s1 | …5d106s1 |
| Металлический радиус, пм | |||
Энергия ионизации
 , эВ , эВ
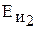 , эВ , эВ
| 7,73 20,29 | 7,58 21,49 | 9,23 20,50 |
| Электроотрицательность: по Полингу по Оллреду-Рохову | 1,90 1,75 | 1,93 1,42 | 2,54 1,42 |
В I группе побочной подгруппе сверху вниз металлический радиус при переходе от меди к серебру увеличивается, а затем остается неизменным, что объясняется лантаноидным сжатием.
В I группе побочной подгруппе наблюдается немонотонно изменение энергии ионизации отрыва первого электрона. В целом по подгруппе сверху вниз энергия ионизации увеличивается, восстановительные свойства атомов уменьшаются.
Из-за роста радиуса при переходе от меди к серебру первая энергия ионизации уменьшается. При переходе от серебра к золоту вследствие того, что металлический радиус остается неизменным, а эффективный заряд ядра возрастает, энергия ионизации увеличивается. Вторая энергия ионизации имеет максимальное значение у серебра, что объясняет его устойчивость в степени окисления +1.
Электроотрицательность по Полингу в I группе побочной подгруппе возрастает от меди к золоту.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 6098; Нарушение авторских прав?; Мы поможем в написании вашей работы!