
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства элементов IV (14) группы главной подгруппы
|
|
|
|
IV группа главная подгруппа
Применение
Германий широко используется как полупроводник. Почти половина производимого олова идет на изготовление жести, главным потребителем которой является производство консервов. Значительное количество олова расходуется на получение сплавов – бронзы (медь + 10 – 20% Sn). Оксид олова (IV) применяется для изготовления полупроводниковых сенсоров. Химические полупроводниковые сенсоры – чувствительные элементы на основе SnО2, In2O3, ZnO, TiO, преобразующие энергию химического процесса в электрическую. Взаимодействие определяемого газа (О2, СО, NО2) с чувствительным материалом сенсора вызывает обратимое изменение его электропроводности, которое регистрируется электронным устройством.
К элементам IV (14 по новой номенклатуре ЮПАК) группы главной подгруппы относятся: углерод С, кремний Si, германий Ge, олово Sn, свинец Pb.
В основном состоянии атомы пниктогенов имеют электронную конфигурацию внешнего энергетического уровня – …ns2 np2, где n – главное квантовое число (номер периода). Для атомов элементов IV группы главной подгруппы характерны следующие степени окисления: для углерода – (–4, 0, +2, +4); для кремния – (–4, 0, (+2), +4); для германия – ((–4), 0, +2, +4); для олова – (0, +2, +4), для свинца – (0, +2, +4).
Устойчивость соединений с высшей степенью окисления +4 максимальна для кремния и понижается в ряду Ge – Sn – Pb. Это объясняется тем, что затраты энергии на перевод электрона с s на p подуровень не компенсируются энергией образующихся химических связей. Устойчивость соединений со степенью окисления +2 возрастает.
В табл. 1 представлены основные свойства IV (14) группы главной подгруппы.
| Свойство | С | Si | Ge | Sn | Pb |
| Заряд ядра | |||||
| Электронная конфигурация внешнего энергетического уровня в основном состоянии | …2s2 2p2 | …3s2 3p2 | …4s2 4p2 | …5s2 5p2 | …6s2 6p2 |
| Орбитальный радиус, пм | |||||
Энергия ионизации
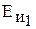 , эВ , эВ
| 11,26 | 8,15 | 7,90 | 7,34 | 7,42 |
Энергия сродства к электрону, 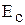 , эВ , эВ
| 1,26 | 1,38 | 1,2 | 1,2 | – |
| Температура плавления, ºС | 3300 (субл.) | ||||
| Температура кипения, ºС | – | ||||
| Электроотрицательность: по Полингу по Оллреду-Рохову | 2,55 2,50 | 1,90 1,74 | 2,01 2,02 | 1,96 1,72 | 2,33 1,55 |
В IV группе главной подгруппе сверху вниз орбитальный радиус увеличивается. Неравномерное изменение радиуса при переходе от Si к Ge и от Sn к Pb обусловлено эффектами d и f-сжатия. Электроны 3d и 4f-подуровней слабо экранируют заряд ядер атомов. Это приводит к сжатию электронных оболочек германия и свинца из-за повышения эффективного заряда ядра.
В IV группе главной подгруппе сверху вниз эффективный заряд ядра увеличивается, орбитальный радиус также увеличивается, энергия ионизации уменьшается, восстановительные свойства атомов возрастают.
Углерод отличается от других атомов элементов IV группы главной подгруппы высоким значением энергии ионизации.
Атом углерода не имеет свободных d-орбиталей, валентные электроны атома углерода (... 2s2 2p2) слабо экранированы от действия ядра, что объясняет небольшой радиус атома углерода и высокие значения энергии ионизации и электроотрицательности.
В IV группе главной подгруппе сверху вниз эффективный заряд ядра увеличивается, орбитальный радиус увеличивается, энергия сродства к электрону уменьшается, окислительные свойства атомов уменьшаются.
Энергия сродства к электрону у атома углерода меньше, чем у атома кремния, что связано с небольшим радиусом атома углерода и сильным межэлектронным отталкиванием при присоединении электрона к атому.
В IV группе главной подгруппе сверху вниз энергия ионизации уменьшается, энергия сродства к электрону уменьшается, электроотрицательность уменьшается.
С изменением энергии ионизации свойства элементов IV группы главной подгруппы изменяются от типичных неметаллов к металлам. Углерод и кремний – типичные неметаллы, германий – металлоид с характерными металлическими свойствами, олово, свинец – металл.
В IV группе главной подгруппе сверху вниз температуры плавления и кипения уменьшаются.
Понижение температуры плавления обусловлено увеличением доли металлической связи.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 3007; Нарушение авторских прав?; Мы поможем в написании вашей работы!