
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства азота
Физические свойства азота
Азот при обычных условиях – бесцветный газ, не имеющий вкуса и запаха, состоящий из двухатомных молекул N2. Для азота характерны низкие температуры кипения и плавления. Азот плохо растворим в воде и в органических растворителях. Растворимость в воде возрастает при повышении давления.
Структура твердого азота построена из молекул N2, связанных слабыми силами Ван-дер-Ваальса.
Конфигурация внешних энергетического уровня у атома азота …2s22p3. Атом азота имеет три неспаренных электрона и может образовать три ковалентные связи. В результате донорно-акцепторного взаимодействия атом азота может приобретать положительный и отрицательный заряд. В возбужденном ионе N+ имеется четыре неспаренных электрона, в этом состоянии азот образует четыре ковалентные связи. Ион N– имеет только два неспаренных электрона и может образовывать только две ковалентные связи. У атома азота нет свободных d-орбиталей, поэтому атом азота не может образовывать больше четырех ковалентных связей.
Молекулярный азот обладает очень низкой реакционной способностью. Это связано с наличием в молекуле азота прочной тройной связью, а также неполярностью молекулы азота (энергия тройной связи в молекуле N2 равна 940 кДж/моль, длина связи 110 пм). Таким образом, молекула азота очень прочная и протекание химических реакций требует высоких энергий активации. Азот – инертное вещество при обычных условиях. Только при высоких температурах азот вступает в химические реакции.
1. При комнатной температуре азот реагирует с литием, с образованием нитрида лития:
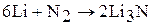
2. С металлами азот реагирует при нагревании. При этом он проявляет свойства окислителя:


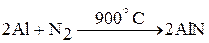
2. Азот как восстановитель реагирует с кислородом (в электрическом разряде) и фтором (при высоких температурах):
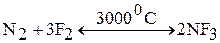

3. Азот реагирует с водородом. Данная реакция протекает при повышенных значениях температуры (400 ºС) и давления 200 атм, а также в присутствии катализатора (Fe):
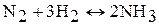
С серой и галогенами азот не взаимодействует.
В электрическом разряде происходит переход электрона с орбитали δ (2рz) на p* (2рх) (метод МО ЛКАО). Такие возбужденные молекулы быстро возвращаются в обычное состояние, испуская желтое свечение. Иногда оно длится несколько минут после прекращения разряда. В возбужденном состоянии азот обладает высокой реакционной способностью. Атомарный азот активен при обычных условиях и взаимодействует с серой, фосфором и ртутью и др. элементами.
|
|
Дата добавления: 2014-01-15; Просмотров: 1771; Нарушение авторских прав?; Мы поможем в написании вашей работы!