
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Следовательно, уравнение состояния для моля идеального газа имеет вид
|
|
|
|
РV=RT. (4)
Для произвольной массы m газа можно переписать уравнение (4) в виде
РV=(m/M)RT или РV=nRT, (5)
где n=m/M - число молей. Очевидно, что
n=N/NA, (6)
где N - число молекул, содержащихся в массе газа m.
В такой наиболее общей форме записи уравнение состояния идеального газа (5) называется уравнением Клапейрона-Менделеева.
Употребляется еще одна форма уравнения (5). Введем постоянную Больцмана
k=R/NA. (7)
Тогда из уравнения (5) получим
РV= (N/NA)RT=NkT. (8)
Разделив обе части этого уравнения на объем газа V получим
Р= nkT, (9)
где n=N/V - концентрация молекул, м-3.
Уравнения (1), (5), (8), (9) представляют собой различные формы записи уравнения состояния идеального газа.
Под термодинамическим процессом понимают всякое изменение состояния рассматриваемой системы, характеризующееся изменением ее термодинамических параметров Р,V,T.
Примерами простейших термодинамических процессов могут служить:
1. Изотермический процесс, при котором температура системы не изменяется (T=const). Для него согласно (5), РV=const.
2. Изобарический процесс, происходящий при постоянном давлении в системе (Р=const). Для него согласно (5), V=С1Т.
3. Изохорический процесс, происходящий при постоянном объеме системы (V=const). Для него согласно (5), P=С2Т.
4. Адиабатический процесс, происходящий без теплообмена между системой и внешней средой. Для него, как будет показано в 7.4, 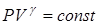 , где γ – показатель адиабаты (γ >1).
, где γ – показатель адиабаты (γ >1).
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 281; Нарушение авторских прав?; Мы поможем в написании вашей работы!