
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. 4.10.1. Энтропия в термодинамике
|
|
|
|
4.10.1. Энтропия в термодинамике
При изучении ПНТ (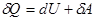 ) отмечалось, что dU является полным дифференциалом (из математики известно, что дифференциал dU называется полным, если интеграл
) отмечалось, что dU является полным дифференциалом (из математики известно, что дифференциал dU называется полным, если интеграл 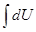 не зависит от пути интегрирования и, в частности, интеграл по замкнутому пути или контуру L
не зависит от пути интегрирования и, в частности, интеграл по замкнутому пути или контуру L 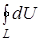 =0), а dQ и dА не являются полными дифференциалами.
=0), а dQ и dА не являются полными дифференциалами.
Из математики также известно, что величина, на которую надо умножать некоторое выражение, чтобы оно стало полным дифференциалом, называется интегрирующим множителем. В термодинамике доказывается, что для обратимого процесса таким интегрирующим множителем является 1/Т и тогда dQ/Т будет являться полным дифференциалом некоторой пока неизвестной нам функции состояния S системы, т.е. dQ/Т=dS. (25)
Определенную таким образом функцию состояния S термодинамической системы называют энтропией, измеряется она в Дж/К. Из (25) видно, что dS и dQ имеют один и тот же знак. Это позволяет по характеру изменения энтропии судить о направлении процесса теплообмена. Понятие энтропии было введено в 1865 г. Клаузиусом.
ПНТ (8) для идеального газа произвольной массы m с учетом формул U=(i/2)nRT=nCVT, CV=(i/2)R, PV=nRT (n=m/M – число молей) принимает вид 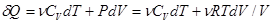 и полный дифференциал энтропии
и полный дифференциал энтропии
dS = dQ/Т=n(CVdT/T+RdV/V) =n(CVd ln T+Rd ln V) (26)
Так как для постоянной массы идеального газа PV/T=const, то
ln P +ln V -ln T = const, а d ln P + d ln V - d ln T =0 и выражение (26) можно переписать в двух эквивалентных ему формах
dS = n[(CV+R)d ln T-Rd ln P]=n[CP(dT/T)-R(dP/P)], (27)
dS = n[(CV+R)d ln V+CVd ln P]=n[CP(dV/V)+CV(dP/P)]. (28)
Если система переходит из состояния 1, характеризующегося параметрами P1, V1, T1, в состояние 2, характеризующееся параметрами P2, V2, T2, то изменение энтропии согласно (26) – (28) DS=S2-S1 =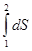 = n[CV ln(T2/T1) +R ln(V2/V1)]=
= n[CV ln(T2/T1) +R ln(V2/V1)]=
= n[CP ln(T2/T1) -R ln(P2/P1)]= n[CP ln(V2/V1)+ CV ln(P2/P1)]. (29)
В частности, если процесс круговой, то P2=P1, V2=V1, T2=T1, из (29) следует, что
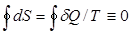 , (30)
, (30)
т.е. действительно dS=dQ/T является полным дифференциалом функции состояния S – энтропии.
Так как для адиабатического процесса dQ=TdS=0, то, следовательно, dS=0 и S=const. Таким образом, обратимый адиабатический процесс представляется собой изоэнтропийный процесс.
Формулы (26)-(29) позволяют построить термодинамические диаграммы T-S, см. рис.9. Пусть точка О изображает начальное состояние идеального газа, тогда
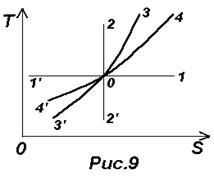 прямая 1-1¢ соответствует изотермическому процессу (0-1 – расширение и уменьшение давления, 0-1¢ - сжатие и увеличение давления). Прямая 2-2¢ соответствует адиабатическому (изоэнтропийному) процессу (0-2 – сжатие и увеличение давления и температуры, 1-2¢ - расширение и уменьшение давления и температуры). Изохорный процесс изображен линией 3-3¢ (0-3 – нагревание и увеличение давления, 0-3¢ - охлаждение и уменьшение давления).
прямая 1-1¢ соответствует изотермическому процессу (0-1 – расширение и уменьшение давления, 0-1¢ - сжатие и увеличение давления). Прямая 2-2¢ соответствует адиабатическому (изоэнтропийному) процессу (0-2 – сжатие и увеличение давления и температуры, 1-2¢ - расширение и уменьшение давления и температуры). Изохорный процесс изображен линией 3-3¢ (0-3 – нагревание и увеличение давления, 0-3¢ - охлаждение и уменьшение давления).
Изобарический процесс изображен линией 4-4¢, идущей положе изохоры 3-3¢ (0-4 – нагревание и расширение, 0-4¢ – охлаждение и сжатие).
Итак, энтропию S можно рассматривать как точно такой же параметр, как и три другие параметра P, V, T. Подобно тому как уравнение состояния идеального газа PV=nRT позволяет выразить, например Т, через другие параметры P и V, так и выражение (29) дает возможность выразить S через другие параметры системы P, V и Т.
4.10.2. Энтропия с кинетической точки зрения. Третье начало термодинамики
Энтропия, введенная здесь термодинамически, успешно используется при вычислениях в термодинамике.
Однако, существует и другое толкование энтропии. С кинетической точки зрения энтропию лучше всего определить как меру неупорядоченности системы. Когда мы охлаждаем систему (например, газ) при постоянном объеме, мы непрерывно извлекаем из нее тепло и, следовательно, энтропию [см.формулу (25) и ее комментарий], т.е. dQ<0 и dS<0. При этом тепловое движение, которое создает неупорядоченность, становится все менее интенсивным и упорядоченность системы повышается. Когда газ конденсируется в жидкость, молекулы занимают более определенные положения друг относительно друга, в отличие от их положения в газовой фазе. Причем скачкообразное уменьшение беспорядка соответствует скачкообразному уменьшению энтропии. При дальнейшем понижении температуры жидкости тепловое движение, которое создает неупорядоченность, становится все менее интенсивным, и происходит дальнейшее уменьшение энтропии.
Когда жидкость отвердевает, молекулы в кристалле занимают вполне определенные положения одна относительно другой, так что неупорядоченность скачком уменьшается. Соответственно при отвердевании выделяется тепло и энтропия также убывает скачком. При абсолютном нуле тепловое движение полностью прекращается, следовательно, неупорядоченность будет также равна нулю. В связи с этим энтропию всех веществ при T=0 принимают равной нулю.
Утверждение: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина, т.е. 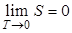 называют третьим началом термодинамики или теоремой Нернста-Планка (1906 г, 1910 г).
называют третьим началом термодинамики или теоремой Нернста-Планка (1906 г, 1910 г).
Представление об энтропии как мере неупорядоченности системы хорошо описывает ее зависимость не только от температуры, но и от объема и других параметров системы.
4.10.3. Энтропия в равновесной статистической физике
Более глубокий смысл энтропии вскрывается в статистической физике: энтропия связывается с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы или число микросостояний, осуществляющих данное макросостояние. По определению W³ 1, т.е. термодинамическая вероятность не есть верояность Р в математическом смысле (Р £1).
Например, макросостояние моля кислорода, соответствующее Р =1 физической атмосфере и Т =300К, может быть осуществлено числом микросостояний W =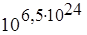 . Представить себе это число совершенно невозможно.
. Представить себе это число совершенно невозможно.
Больцман в 1872 г. показал, что энтропия системы и термодинамическая вероятность связаны между собой следующей формулой
S=k ln W, (31)
где k – постоянная Больцмана. Для выше приведенного примера S =200 Дж/К.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 681; Нарушение авторских прав?; Мы поможем в написании вашей работы!