
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление ионно-обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами осадка, газа или слабого электролита
|
|
|
|
1. Образование малорастворимого соединения, выпадающего в виде осадка: AgNO3 + NaCl = AgCl↓ + NaNO3 (молекулярное уравнение)
Ag+ + NO3 – + Na+ + Cl – = AgCl↓ + Na+ + NO3 – (полное ионное уравнение)
Ag+ + Cl – = AgCl↓ (сокращенное ионное уравнение).
2. Образование газообразного вещества, удаляемого из раствора:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
2Na+ + CO32 – + 2H+ + SO42 – = 2Na+ + SO42 – + H2O + CO2↑
CO32 – + 2H+ = H2O + CO2↑
3. Образование растворимого, но мало диссоциированного вещества, например, воды, слабой кислоты или слабого основания:
CH3COONa + H2SO4 = Na2SO4 + CH3COOH
CH3COO –+ Na+ = 2Na+ +SO42 –+ CH3COOH
CH3COO – + H+ = CH3COOH;
4. Образование устойчивой комплексной частицы – молекулы или иона:
HgI2 + 2KI = K2[HgI4]
Hg2+ + 2I – + 2K+ + 2I – = 2K+ + [HgI4]2 –
Hg2+ + 4I – = [HgI4]2 –
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуются соль и вода, например: NaOH + HCl = NaCl + H2O или OH – + H+ = H2O.
При нейтрализации сильного основания сильной кислотой равновесие практически полностью смещено в сторону образования воды. Реакции нейтрализации при взаимодействии кислот и оснований, различающихся по силе, не доходят до конца вследствие протекания обратной реакции гидролиза соли, например: СН3СООН + NaOH 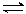 CH3COONa + Н2О
CH3COONa + Н2О
СН3СООН + ОН- 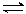 СН3СОО- + Н2О.
СН3СОО- + Н2О.
Реакции нейтрализации экзотермические и протекают с выделением тепла.
Контрольные вопросы:
1. Произведение растворимости.
2. Растворимость и ее связь с произведением растворимости.
3. Условия образования и растворения осадков.
4. Ионно-обменные реакции.
5. Направление протекания ионно-обменных реакций.
6. Реакции нейтрализации.
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 252 - 258.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 232 - 234.
А.Т. Чанышева
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 583; Нарушение авторских прав?; Мы поможем в написании вашей работы!