
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический состав газовой смеси
|
|
|
|
Химический состав газовой смеси может задаваться тремя различными способами.
Рассмотрим газовую смесь, состоящую из n компонентов. Смесь занимает объём V см, м3, имеет массу М см, кг, давление р см, Па и температуру Т см, К. Также число молей смеси равно N см, моль. При этом масса одного i -го компонента mi, кг, а число молей этого компонента νi, моль.
Очевидно, что:
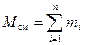 , (4)
, (4)
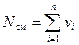 . (5)
. (5)
Используя для рассматриваемой смеси закон Дальтона (2) и Амага (3) можно записать:
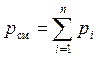 , (6)
, (6)
 , (7)
, (7)
где рi – парциальное давление i -го компонента, Па; Vi – приведённый объём i -го компонента, м3.
Однозначно химический состав газовой смеси может быть задан либо массовыми, либо мольными, либо объёмными долями её компонентов:
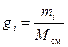 , (8)
, (8)
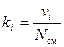 , (9)
, (9)
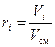 , (10)
, (10)
где gi, ki и ri – массовая, мольная и объёмная доли i -го компонента смеси соответственно (безразмерные величины).
Очевидно, что:
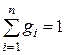 ,
,  ,
,  . (11)
. (11)
Часто на практике химический состав смеси задаётся не долями i -го компонента, а его процентами.
Например, в теплотехнике приближённо принимается, что сухой воздух состоит из 79 объёмных процентов азота и 21 объёмного процента кислорода.
Процент i-го компонента в смеси вычисляется путём умножения его доли на 100.
Для примера с сухим воздухом будем иметь:
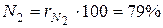 ,
, 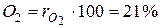 . (12)
. (12)
где  и
и 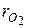 – объёмные доли азота и кислорода в сухом воздухе; N2 и О2 – обозначение объёмных процентов азота и кислорода соответственно, % (об.).
– объёмные доли азота и кислорода в сухом воздухе; N2 и О2 – обозначение объёмных процентов азота и кислорода соответственно, % (об.).
Примечание:
1) Мольные доли идеальной смеси численно равны объёмным долям: ki = ri. Докажем это.
Пользуясь определением объёмной доли (10) и законом Амага можем записать:
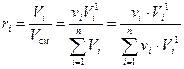 , (13)
, (13)
где Vi – приведённый объём i-го компонента, м3; νi – число молей i-го компонента, моль;  – объём одного моля i-го компонента при давлении смеси р см и температуре смеси Т см, м3/моль.
– объём одного моля i-го компонента при давлении смеси р см и температуре смеси Т см, м3/моль.
Из закона Авогадро (см. п. 2.3) данного приложения следует, что при одинаковых температуре и давлении один моль любого газа (компонента смеси) занимает один и тот же объём, в частности, при Т см и р см это будет некоторый объём V 1, м3.
Сказанное позволяет записать равенство:
 . (14)
. (14)
Подставляя (14) в (13) получаем требуемое:
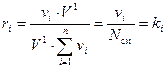 . (15)
. (15)
2) Объёмные доли компонентов газовой смеси можно рассчитать, зная их парциальные давления. Покажем это.
Рассмотрим i-ый компонент идеальной газовой смеси в двух различных состояниях: когда он находится при своём парциальном давлении рi; когда он занимает свой приведённый объём Vi.
Уравнение состояния идеального газа справедливо для любых его состояний, в частности, и для двух, названных выше.
В соответствии с этим, и учитывая определение удельного объёма, можем записать:
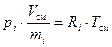 , (16)
, (16)
и
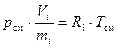 , (17)
, (17)
где Ri – газовая постоянная i-го компонента смеси, Дж/(кг · К).
После деления обоих частей (16) и (17) друг на друга получаем требуемое:
 . (18)
. (18)
Из (18) видно, что парциальные давления компонентов смеси можно рассчитать по её химическому составу, при известном общем давлении смеси р см:
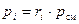 . (19)
. (19)
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1721; Нарушение авторских прав?; Мы поможем в написании вашей работы!