
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия и цикл Карно
|
|
|
|
Введение понятия энтропии позволяет простым способом оценить к.п.д. цикла Карно и ответить на вопрос, как оптимизировать процесс, чтобы к.п.д. стал наибольшим.
Форма цикла Карно на p-V диаграмме зависит от рабочего тела (наклон адиабаты на участках 2-3 и 4-1 (рис. 10.5.1) зависит от показателя адиабаты  , определяемой числом степеней свободы газа). В переменных T-S цикл Карно имеет более простой вид (рис. 10.8.1): отрезки горизонтальных прямых 1-2 и 3-4 соответствуют изотермам, участки 2-3 и 4-1 – адиабатам (или изотропам).
, определяемой числом степеней свободы газа). В переменных T-S цикл Карно имеет более простой вид (рис. 10.8.1): отрезки горизонтальных прямых 1-2 и 3-4 соответствуют изотермам, участки 2-3 и 4-1 – адиабатам (или изотропам).
 Диаграмма процесса в координатах T-S называется энтропийной диаграммой. Ее вид не зависит от рода рабочего тела.
Диаграмма процесса в координатах T-S называется энтропийной диаграммой. Ее вид не зависит от рода рабочего тела.
По определению:
 .
.
Полезная работа  . Из рисунка видно, что
. Из рисунка видно, что  , а
, а  . Поэтому:
. Поэтому:
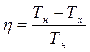 ,
,
что соответствует ранее полученной формуле. Геометрический смысл: к.п.д. – это отношение площадей прямоугольников 1-2-3-4 и 1-2-5-6-1. Преимущества энтропийной диаграммы, позволяющей сравнительно просто вычислить количество теплоты, полученное или отданное рабочим телом, определило ее широкое применение в технике.
К.п.д. существующих тепловых двигателей не превышает 25%. Таким образом, большая часть энергии расходуется не на совершение полезной работы, а на нагрев окружающей среды.
Глава 11. Реальные газы
11.1. Уравнение состояния реального газа (Ван-дер-Ваальса)
Поведение идеальных газов описывается уравнением Клапейрона – Менделеева, которое для одного моля газа имеет вид
 .
.
Большинство газов при нормальных условиях можно считать идеальными, но с понижением температуры и с повышением давления газа наблюдаются значительные отклонения его поведения от уравнения состояния идеального газа. Причина состоит в том, что во всех телах молекулы имеют собственный объем и взаимодействуют друг с другом. Исходя из этого, голландский физик И. Ван-дер-Ваальс ввел в уравнение Клапейрона – Менделеева две поправки и вывел уравнение состояния реального газа.
|
|
|
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактически свободный объем, в котором могут двигаться молекулы реального газа, будет не  , а
, а 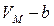 , где
, где  объем, занимаемый самими молекулами.
объем, занимаемый самими молекулами.
 Вычислим величину поправки
Вычислим величину поправки  . Обозначим через
. Обозначим через 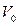 объем одной молекулы. Если число молекул в газе N, то суммарный объем всех молекул
объем одной молекулы. Если число молекул в газе N, то суммарный объем всех молекул  . Но объем V, недоступный для движения молекул, больше объема
. Но объем V, недоступный для движения молекул, больше объема  . Действительно, при соударении две молекулы А и В сближаются на расстояние d, равное диаметру молекулы (рис. 11.1.1). Молекула А создает для молекулы В недоступную сферу, радиус которой равен d, а объем
. Действительно, при соударении две молекулы А и В сближаются на расстояние d, равное диаметру молекулы (рис. 11.1.1). Молекула А создает для молекулы В недоступную сферу, радиус которой равен d, а объем  . То же самое справедливо по отношению к молекуле В. Это значит, что для каждых двух молекул недоступный для их движения объем в восемь раз больше объема одной молекулы. Уменьшение свободного объема, рассчитанное на одну молекулу, равно
. То же самое справедливо по отношению к молекуле В. Это значит, что для каждых двух молекул недоступный для их движения объем в восемь раз больше объема одной молекулы. Уменьшение свободного объема, рассчитанное на одну молекулу, равно  . Для N молекул уменьшение свободного объема равно
. Для N молекул уменьшение свободного объема равно
 . (11.1.1)
. (11.1.1)
Зная радиус молекулы r (параграф 7.2), можно вычислить поправку b.
2. Учет притяжения молекул. Кроме сил отталкивания, между молекулами действуют сила взаимного притяжения. Эти два вида сил действуют одновременно (в противном случае тела не были бы устойчивы: образующие их частицы разлетались бы или, наоборот, слипались). Эти силы проявляются на расстоянии  м и быстро убывают с увеличением расстояния, следовательно, являются короткодействующими. На рис. 11.1.2 а) приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где F0 и Fn – соответственно силы отталкивания и притяжения, а F – их результирующая (силы
м и быстро убывают с увеличением расстояния, следовательно, являются короткодействующими. На рис. 11.1.2 а) приведена качественная зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где F0 и Fn – соответственно силы отталкивания и притяжения, а F – их результирующая (силы  отталкивания считаются положительными, а силы притяжения – отрицательными). На расстоянии
отталкивания считаются положительными, а силы притяжения – отрицательными). На расстоянии 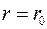 результирующая сила F =0, т.е. силы притяжения и отталкивания уравновешивают друг друга.
результирующая сила F =0, т.е. силы притяжения и отталкивания уравновешивают друг друга.
|
|
|
Работа 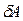 по удалению двух молекул на расстояние
по удалению двух молекул на расстояние  равна
равна  и происходит за счет убывания потенциальной энергии их взаимодействия:
и происходит за счет убывания потенциальной энергии их взаимодействия:  ,откуда
,откуда  . Следовательно, в состоянии устойчивого равновесия
. Следовательно, в состоянии устойчивого равновесия  система обладает минимальной потенциальной энергией.
система обладает минимальной потенциальной энергией.
Соотношение между  и энергией теплового движения молекул
и энергией теплового движения молекул  является критерием агрегатного состояния вещества. Если
является критерием агрегатного состояния вещества. Если 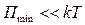 , то вещество находится в газообразном состоянии, т.к. интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния
, то вещество находится в газообразном состоянии, т.к. интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния  . Если
. Если  , то вещество находится в жидком состоянии, т.к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходятся на расстояния, превышающие
, то вещество находится в жидком состоянии, т.к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходятся на расстояния, превышающие  . Если
. Если  , то вещество находится в твердом состоянии, т.к. молекулы не могут удалиться на значительные расстояния и колеблются около положения равновесия, определяемого расстоянием
, то вещество находится в твердом состоянии, т.к. молекулы не могут удалиться на значительные расстояния и колеблются около положения равновесия, определяемого расстоянием  .
.
 Найдем поправку а, учитывающую силы взаимного притяжения молекул. Рассмотрим молекулу А, расположенную внутри газа (рис. 11.1.3). Построим вокруг молекулы сферу с радиусом, равным радиусу молекулярного действия
Найдем поправку а, учитывающую силы взаимного притяжения молекул. Рассмотрим молекулу А, расположенную внутри газа (рис. 11.1.3). Построим вокруг молекулы сферу с радиусом, равным радиусу молекулярного действия  .
.
Все молекулы, удаленные от молекулы А на расстояние, не превышающие  , взаимодействуют с ней. Поскольку плотность газа одинакова, то результирующая сил, действующих на молекулу со стороны всех других молекул, равна нулю. Значит, на молекулы газа, удаленные от стенок на расстояние
, взаимодействуют с ней. Поскольку плотность газа одинакова, то результирующая сил, действующих на молекулу со стороны всех других молекул, равна нулю. Значит, на молекулы газа, удаленные от стенок на расстояние 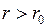 , силы межмолекулярного притяжения влияния не оказывают.
, силы межмолекулярного притяжения влияния не оказывают.
Рассмотрим молекулу В, расположенную вблизи стенки сосуда. Построим вокруг этой молекулы сферу молекулярного действия. Эта сфера частично лежит за пределами объема, занимаемого газом. Вследствие этого действие на молекулу В со стороны молекул, расположенных правее сечения SS1, не уравновешивается аналогичным действием слева. Такое рассуждение можно провести относительно всех молекул, расположенных около стенки сосуда в молекулярном слое толщиной порядка 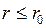 .
.
На все эти молекулы действует сила F, направленная от стенки внутрь газа.
В результате давления, обусловленного силами молекулярного притяжения, давление газа на стенку будет на некоторую величину  меньше давления
меньше давления 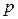 , вычисленного без учета сил молекулярного притяжения
, вычисленного без учета сил молекулярного притяжения
|
|
|

Величину поправки  вычислить не удается. Но можно считать, что сила, действующая на молекулу, пропорциональна концентрации молекул n. Так как число молекул, расположенных у стенки сосуда, также пропорционально концентрации n, то уменьшение давления
вычислить не удается. Но можно считать, что сила, действующая на молекулу, пропорциональна концентрации молекул n. Так как число молекул, расположенных у стенки сосуда, также пропорционально концентрации n, то уменьшение давления  пропорционально
пропорционально  . Поскольку концентрация обратно пропорциональна объему газа, то
. Поскольку концентрация обратно пропорциональна объему газа, то

где а – искомая поправка.
Таким образом,  или
или
 . (11.1.2)
. (11.1.2)
Это уравнение – уравнение состояния реального газа (уравнение Ван-дер-Ваальса). Величины а и b в уравнении Ван-дер-Ваальса могут быть измерены экспериментально (для каждого газа).
Для того, чтобы перейти к уравнению Ван-дер-Ваальса для произвольной массы газа m, нужно учесть, что  молей газа занимают объем
молей газа занимают объем  . Заменяя
. Заменяя  , получим
, получим
 (11.1.3)
(11.1.3)
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1833; Нарушение авторских прав?; Мы поможем в написании вашей работы!