
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Навчальний текст із запитаннями для роздумів
|
|
|
|
1. Атом складається з ядра й електронної хмари, що його оточує. Розмір “хмари” приблизно на п’ять порядків більший за розмір ядра (у сто тисяч разів). Якщо атом уявити збільшеним настільки, що ядро буде мати “діаметр” близько 1 мм, тоді розмір електронної хмари збільшиться до сотні метрів. Але сумарна маса електронів “хмари” у тисячі разів менша за масу ядра. Іншими словами, практично всю масу атома складає маса ядра.
Запитання для роздумів: 1) Якщо атом такий “порожній” (об’єм, що займає ядро, на п’ятнадцять порядків менший за загальний об’єм атома), то чому ми не відчуваємо цієї “порожнистості”, скажімо, у твердих тіл? 2) Як один електрон в атомі водню (за новою термінологією — Гідрогену) може утворювати електронну хмару?
2. Ядро атома утворюється з двох типів частинок. Одні називають протонами, а інші — нейтронами. Перші заряджені позитивно, а другі — нейтральні. Заряд протона дорівнює заряду електрона за модулем, але відрізняється за знаком. У ядрі атома стільки ж протонів, скільки електронів знаходиться в електронній хмарі, яка оточує ядро. Тому атом електрично нейтральний. Якщо у “хмарі” виникає надлишок або брак електронів, тоді говорять, що атом перетворився на іон. Маси нейтрона і протона практично однакові (у нейтрона трохи більше). Для нейтронів та протонів існує загальна назва. Їх називають нуклонами (Згадайте, як буде англійською словосполучення “ядерна зброя”!). Оскільки маса атома фактично визначається кількістю нуклонів, то цю кількість називають не тільки нуклонним числом, а часто і масовим числом, та позначають літерою A.
Запитання для роздумів: 1) Як відомо, однойменно заряджені тіла відштовхуються одне від одного. Чому цього не роблять протони, які містяться у ядрі? 2) А які сили утримують нейтрони в ядрі?
3. Кількість протонів у ядрі атома (і відповідно кількість електронів в електронній хмарі електрично нейтрального атома) визначає його хімічні властивості. Кількість протонів у ядрі атома співпадає з порядковим номером відповідного хімічного елемента у таблиці Д.І. Менделєєва. Якщо заряд протона умовно прийняти за одиницю, то заряд ядра в цих умовних одиницях буде дорівнювати числу протонів. Тому кількість протонів у ядрі називають не тільки протонним числом, а часто і зарядовим числом, та позначають літерою Z.
Запитання для роздумів: 1) Чи впливає кількість електронів у “хмарі” на її форму? 2) Чому при монотонному зростанні зарядового числа спостерігається певна періодичність хімічних властивостей атомів?
4. Атом, для якого відомі протонне і нуклонне числа (тобто з цілком визначеним складом ядра), називають нуклідом, використовуючи для нього позначення типу 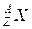 , де символ
, де символ 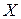 повинен бути замінений на символ відповідного хімічного елемента. Наприклад,
повинен бути замінений на символ відповідного хімічного елемента. Наприклад,  — нуклід хлору (символ
— нуклід хлору (символ 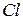 ), у ядрі якого 17 протонів (нижній індекс — 17) і 20 нейтронів (верхній індекс, який відображає загальне число нуклонів, — 37, а 37–17=20). Звичайно, можна обмежитись таким записом:
), у ядрі якого 17 протонів (нижній індекс — 17) і 20 нейтронів (верхній індекс, який відображає загальне число нуклонів, — 37, а 37–17=20). Звичайно, можна обмежитись таким записом: 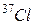 . Але у цьому випадку потрібно пам’ятати, що
. Але у цьому випадку потрібно пам’ятати, що 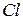 займає у таблиці Д.І. Менделєєва комірку під номером 17, або мати цю таблицю під руками.
займає у таблиці Д.І. Менделєєва комірку під номером 17, або мати цю таблицю під руками.
Ядра атомів одного і того ж хімічного елемента, як уже було сказано, мають однакове число протонів (яке співпадає з номером комірки, відведеної під цей хімічний елемент у таблиці Д.І. Менделєєва), але можуть мати різне число нейтронів (і відповідно різну масу). Так, існують нукліди хлору не лише з масовим (нуклонним) числом, що дорівнює 37, а і нукліди 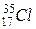 . Причому останні на Землі зустрічаються приблизно втричі частіше. Нукліди одного і того ж хімічного елемента (тобто з однаковим числом протонів у ядрі), які відрізняються масою, бо мають різне число нейтронів, називають ізотопами. У таблиці Д.І. Менделєєва не виділяють комірки під кожний нуклід. Усі нукліди одного і того ж хімічного елемента (тобто його ізотопи) опиняються в одній комірці. Тому вони так і називаються (ізо - від “однаковий”, а - топ перекладається як “місце”).
. Причому останні на Землі зустрічаються приблизно втричі частіше. Нукліди одного і того ж хімічного елемента (тобто з однаковим числом протонів у ядрі), які відрізняються масою, бо мають різне число нейтронів, називають ізотопами. У таблиці Д.І. Менделєєва не виділяють комірки під кожний нуклід. Усі нукліди одного і того ж хімічного елемента (тобто його ізотопи) опиняються в одній комірці. Тому вони так і називаються (ізо - від “однаковий”, а - топ перекладається як “місце”).
Запитання для роздумів: 1) Якщо нукліди одного і того ж хімічного елемента не відрізняються за своїми хімічними властивостями, то яким чином можна було відкрити ізотопи? 2) Якщо майже у кожного хімічного елемента існують ізотопи, то масу якого з них наводять у таблиці Д.І. Менделєєва?
5. У таблиці Д.І. Менделєєва доводиться вказувати усереднену масу ізотопів кожного хімічного елемента. Таке усереднення виявляється можливим, оскільки ізотопний склад хімічних елементів практично однаковий у різних куточках Землі. Для багатьох хімічних елементів спостерігається явна перевага вмісту одного ізотопу в природній суміші. Але бувають і цілком порівнянні числа. Крім хлору, про який ми говорили, згадаємо про мідь: для 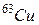 і
і 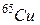 масові вмісти у природній суміші відносяться приблизно як 7:3. Це призводить до того, що неможливо обрати умовну одиницю маси так, щоб атомні маси всіх хімічних елементів у таблиці Д.І. Менделєєва виражались числами, які були б достатньо близькими до цілих, адже у кожного ізотопу одного і того ж хімічного елемента своє, відмінне від інших, число нуклонів у ядрі, кількістю яких і визначається в основному маса нукліда (див. крім
масові вмісти у природній суміші відносяться приблизно як 7:3. Це призводить до того, що неможливо обрати умовну одиницю маси так, щоб атомні маси всіх хімічних елементів у таблиці Д.І. Менделєєва виражались числами, які були б достатньо близькими до цілих, адже у кожного ізотопу одного і того ж хімічного елемента своє, відмінне від інших, число нуклонів у ядрі, кількістю яких і визначається в основному маса нукліда (див. крім 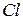 і
і 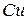 , наприклад,
, наприклад,  ,
, 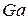 ,
,  ,
, 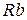 ,...).
,...).
Інша справа — таблиця нуклідів. Маси нуклідів можна виразити у таких одиницях, що їхні числові значення будуть практично співпадати з відповідними нуклонними (масовими) числами. Таблицю, у якій наведені маси нуклідів з великою точністю, можна знайти, наприклад, у багатьох збірниках задач з фізики (у додатках). Знайдіть таку таблицю та уважно її розгляньте. У яких одиницях наведені маси нуклідів? Зверніть увагу на те, що деякі автори не використовують слово “нуклід”, і таблиця може називатись так: “Відносна атомна маса деяких ізотопів”.
Краще було б останнє слово замінити на слово “нукліди” у відповідному відмінку, а про ізотопи говорити, коли мова йде про різні нукліди якого-небудь уже виділеного хімічного елемента. Наприклад, ізотопи хлору, ізотопи вуглецю тощо. Але Ви маєте бути готовими і до того, що деякі автори надають перевагу використанню слова “ізотопи” також і у випадку таблиці нуклідів. На це є свої історичні причини. А слово “нуклід” іноді використовують не для позначення атома з певним ядром, а для позначення власне самого ядра. Причому обидва розуміння цього слова зустрічаються в однаково поважних енциклопедичних виданнях, які виходили майже одночасно. Але повернемося до таблиці нуклідів. Звернемо увагу на нуклід 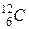 (ізотоп вуглецю
(ізотоп вуглецю 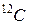 , вуглець-12 чи Карбон-12). Атомна маса цього нукліда згідно з таблицею складає 12,00000 а.о.м. Зрозуміло, що таке число не могло бути результатом вимірювання. Така дивовижна точність повинна бути пов’язана з вибором тієї одиниці маси, яка представлена буквами “а.о.м.”.
, вуглець-12 чи Карбон-12). Атомна маса цього нукліда згідно з таблицею складає 12,00000 а.о.м. Зрозуміло, що таке число не могло бути результатом вимірювання. Така дивовижна точність повинна бути пов’язана з вибором тієї одиниці маси, яка представлена буквами “а.о.м.”.
Запитання для роздумів: 1) Нуклід водню 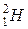 містить у 6 разів менше як протонів, так і нейтронів та електронів, ніж нуклід вуглецю
містить у 6 разів менше як протонів, так і нейтронів та електронів, ніж нуклід вуглецю 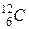 . Чому ж його маса не дорівнює 2,00000 а.о.м.? 2) Згідно з фізичними таблицями маса нуклона (як протона, так і нейтрона) перевищує 1 а.о.м. Чи не суперечить це тому, що маса нукліда
. Чому ж його маса не дорівнює 2,00000 а.о.м.? 2) Згідно з фізичними таблицями маса нуклона (як протона, так і нейтрона) перевищує 1 а.о.м. Чи не суперечить це тому, що маса нукліда 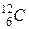 точно дорівнює 12 а.о.м.?
точно дорівнює 12 а.о.м.?
6. Як Ви вже напевно здогадалися, а.о.м. — скорочення слів “ атомна одиниця маси ”. Якщо обрати відносну одиницю маси так, щоб маса нукліда 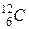 в точності дорівнювала 12 а.о.м., то, як можна впевнитися за таблицею нуклідів, їхні маси в цих відносних одиницях будуть дуже мало відрізнятися від нуклонних чисел, які за своїм означенням є цілими. Але чому орієнтуються саме на нуклід
в точності дорівнювала 12 а.о.м., то, як можна впевнитися за таблицею нуклідів, їхні маси в цих відносних одиницях будуть дуже мало відрізнятися від нуклонних чисел, які за своїм означенням є цілими. Але чому орієнтуються саме на нуклід 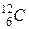 ? Чи не природно було б обрати масу “найлегшого” нукліда
? Чи не природно було б обрати масу “найлегшого” нукліда  за атомну одиницю маси? Звичайно природно! Але... нічого не вийде. Як зміняться числові значення мас нуклідів за такого вибору одиниці маси?
за атомну одиницю маси? Звичайно природно! Але... нічого не вийде. Як зміняться числові значення мас нуклідів за такого вибору одиниці маси?
Зрозуміло, що у такому випадку усі “старі” числові значення мають бути помножені (або, якщо зручніше, поділені) на одне й те саме число (на яке саме у даному випадку?). Після такого перерахунку числове значення маси нукліда  у “нових” одиницях буде, звичайно, в точності дорівнювати одиниці. Числове ж значення маси нукліда
у “нових” одиницях буде, звичайно, в точності дорівнювати одиниці. Числове ж значення маси нукліда 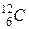 не буде точно дорівнювати 12, але воно не буде і дуже сильно відрізнятися від цілого числа, яке показує кількість нуклонів у ядрі цього нукліда. Впевніться у цьому самостійно! Якщо Ви будете виходити з того, що нуклід
не буде точно дорівнювати 12, але воно не буде і дуже сильно відрізнятися від цілого числа, яке показує кількість нуклонів у ядрі цього нукліда. Впевніться у цьому самостійно! Якщо Ви будете виходити з того, що нуклід  має масу 1,007825 а.о.м. за вуглецевою шкалою (за якою маса
має масу 1,007825 а.о.м. за вуглецевою шкалою (за якою маса 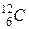 точно дорівнює 12 а.о.м.), то за “водневою” шкалою має вийти 11,90683. А ось якщо ми візьмемо найбільш стабільний ізотоп урану
точно дорівнює 12 а.о.м.), то за “водневою” шкалою має вийти 11,90683. А ось якщо ми візьмемо найбільш стабільний ізотоп урану 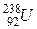 , у якого за вуглецевою шкалою маса дорівнює 238,05076 а.о.м. (порівняйте з нуклонним числом!), то після перерахунку на “водневі” одиниці числове значення дорівнюватиме 236,20247. Отримане число ближче до цілого числа 236, а не до 238, як нам того хотілося. Адже ми хотіли вести мову про уран-238, а не про уран-236, у якого період напіврозпаду на два порядки менший!
, у якого за вуглецевою шкалою маса дорівнює 238,05076 а.о.м. (порівняйте з нуклонним числом!), то після перерахунку на “водневі” одиниці числове значення дорівнюватиме 236,20247. Отримане число ближче до цілого числа 236, а не до 238, як нам того хотілося. Адже ми хотіли вести мову про уран-238, а не про уран-236, у якого період напіврозпаду на два порядки менший!
Отже, природна на перший погляд “воднева” шкала призводила б до подібних незручностей. Звичайно, наведені міркування не пояснюють, чому для введення атомної одиниці маси обирають саме вуглець-12, а не, скажімо, кисень-16. Але зазначимо принагідно, що з точки зору визначення понять, якими користуються в хімії і у фізиці, “киснева” шкала була б нічим не кращою: замість числа 12 у всіх означеннях було б присутнім не менш загадкове число 16. До речі, така шкала у свій час існувала. Вона мала назву фізичної кисневої шкали. Але існувала також і хімічна киснева шкала, де за 16 одиниць приймали не масу нукліда 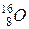 , а середню масу природної суміші ізотопів кисню. І до 1961 року у восьмій комірці таблиці Д.І. Менделєєва, відведеній під кисень (або, як пишуть у сучасних таблицях, Оксиген), можна було побачити число 16,000, яке і було числовим значенням атомної маси кисню за хімічною кисневою шкалою. Наявність одночасно двох шкал (фізичної та хімічної) була незручною. Прийняття спільної і для фізиків, і для хіміків вуглецевої шкали практично не змінило чисел, до яких звикли хіміки. Подивіться на атомну масу кисню у новій (після 1961 року) таблиці Д.І. Менделєєва. Вона, звичайно, зараз не 16,000, але і не дуже сильно змінилася (15,999). З іншого боку, була виконана вимога фізиків прив’язати спосіб введення атомної одиниці маси до певного нукліда, а не до якогось хімічного елемента, коли можна говорити лише про усереднену за всіма ізотопами масу атома.
, а середню масу природної суміші ізотопів кисню. І до 1961 року у восьмій комірці таблиці Д.І. Менделєєва, відведеній під кисень (або, як пишуть у сучасних таблицях, Оксиген), можна було побачити число 16,000, яке і було числовим значенням атомної маси кисню за хімічною кисневою шкалою. Наявність одночасно двох шкал (фізичної та хімічної) була незручною. Прийняття спільної і для фізиків, і для хіміків вуглецевої шкали практично не змінило чисел, до яких звикли хіміки. Подивіться на атомну масу кисню у новій (після 1961 року) таблиці Д.І. Менделєєва. Вона, звичайно, зараз не 16,000, але і не дуже сильно змінилася (15,999). З іншого боку, була виконана вимога фізиків прив’язати спосіб введення атомної одиниці маси до певного нукліда, а не до якогось хімічного елемента, коли можна говорити лише про усереднену за всіма ізотопами масу атома.
Запитання для роздумів: 1) Чому“воднева” шкала призводить до значних відхилень числових значень мас “важких” нуклідів від їхніх нуклонних (масових) чисел? 2) А що таке період напіврозпаду? І чому він різний у ізотопів одного і того ж хімічного елемента?
7. Як у молекулярній фізиці, так і в хімії часто важливою величиною є число частинок N. Наприклад, тиск газу при заданій температурі визначається числом молекул, що припадає на одиницю об’єму, але не залежить від того, які саме молекули складають газ. Однак, число частинок (або, як узагальнено говорять, структурних елементів речовини) зазвичай надто велике. Наприклад, за нормальних умов число молекул будь-якого газу в одному кубічному метрі становить приблизно 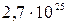 (до речі, ми щойно навели наближене числове значення так званої сталої Лошмідта).
(до речі, ми щойно навели наближене числове значення так званої сталої Лошмідта).
Щоб уникнути таких великих чисел уводять фізичну величину, яка пропорційна розглядуваному числу структурних елементів речовини, але зазвичай має цілком прийнятне числове значення. Цю нову фізичну величину називають кількістю речовини. При цьому, фактично, замість загального числа частинок підраховують число порцій речовини, у кожній з яких міститься велике, але фіксоване число частинок (структурних елементів цієї речовини). Така порція має спеціальну назву — моль. А сталу, яка виражає собою число структурних елементів речовини у такій порції, називають сталою Авогадро та позначають  . Зрозуміло, що кількість речовини, якщо її позначити через
. Зрозуміло, що кількість речовини, якщо її позначити через  , задається виразом
, задається виразом 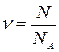 , а її одиницею є моль. З яких же міркувань обирається те фіксоване число структурних елементів, яке міститься в одному молі речовини?
, а її одиницею є моль. З яких же міркувань обирається те фіксоване число структурних елементів, яке міститься в одному молі речовини?
Якщо треба було лише позбавитися великих степенів у числових значеннях, то можна було б домовитися за одиницю кількості речовини прийняти таку порцію, яка містить, скажімо, 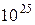 структурних елементів. Але, як відомо, стала Авогадро має досить дивне, на перший погляд, числове значення (
структурних елементів. Але, як відомо, стала Авогадро має досить дивне, на перший погляд, числове значення (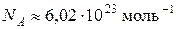 ). Та й означення моля, яке можна знайти у підручниках з хімії та з фізики, виглядає досить заплутаним (... така кількість речовини, у якій міститься стільки структурних елементів, скільки атомів міститься у 0,012 кг...).
). Та й означення моля, яке можна знайти у підручниках з хімії та з фізики, виглядає досить заплутаним (... така кількість речовини, у якій міститься стільки структурних елементів, скільки атомів міститься у 0,012 кг...).
Запитання для роздумів: 1) А навіщо ж такі ускладнення? 2) Що таке нормальні умови? Якщо через них визначається принаймні одна з фізико-хімічних сталих (стала Лошмідта), то ці умови мають бути задані дуже точно.
8. Уведення поняття кількості речовини та її одиниці майже автоматично тягне за собою необхідність уведення ще однієї фізичної величини — молярної маси речовини. Зрозуміло, що маса певної речовини, взятої у кількості одного моля, дорівнює добутку маси структурного елемента цієї речовини на число цих структурних елементів в одному молі. Отже, якщо масу структурного елемента позначити через  , а молярну масу через
, а молярну масу через 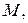 то
то 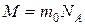 . Зазначимо, що у залежності від структури речовини структурними елементами треба вважати молекули, атоми або інші частинки. Більш того, згідно з Державним стандартом України [66] можна говорити про молярну масу електрона, молярну масу протона тощо. Фактично це означає, що молярна маса формально перераховується з маси відповідної частинки (структурного елемента) множенням її на сталу Авогадро (тобто за формулою, яку ми щойно навели).
. Зазначимо, що у залежності від структури речовини структурними елементами треба вважати молекули, атоми або інші частинки. Більш того, згідно з Державним стандартом України [66] можна говорити про молярну масу електрона, молярну масу протона тощо. Фактично це означає, що молярна маса формально перераховується з маси відповідної частинки (структурного елемента) множенням її на сталу Авогадро (тобто за формулою, яку ми щойно навели).
Але для частинок, про які йдеться, вважалося зручним увести спеціальну одиницю маси — 1 а.о.м. Саме із використанням цієї одиниці записані маси хімічних елементів у таблиці Д.І. Менделєєва, подані маси нуклідів у відповідних таблицях, обчислюють молекулярні маси речовин, для яких відомі хімічні формули. Щоправда, позначення “а.о.м.” часто не пишуть, а також говорять не про молекулярну масу, а про відносну молекулярну масу, яку позначають  (індекс
(індекс 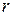 від англ. relative, що означає “відносний”).
від англ. relative, що означає “відносний”).
Молярна маса речовини вимірюється у кг/моль (Державним стандартом іноді дозволяється (!) у г/моль). Було б зручно, щоб числові значення молярної маси і відносної молекулярної маси збігалися. Історично склалося так, що у той час, коли вводилося поняття кількості речовини, за основну одиницю маси брали 1 г, а не 1 кг, як це робиться у Міжнародній системі одиниць. Тому одиницю кількості речовини обрали так, щоб збігалися відносна молекулярна маса (тобто, фактично, маса молекули, виражена в а.о.м.) і молярна маса, виражена у г/моль. Звичайно, за таку зручність доводиться “платити”. Саме тому один моль речовини складається не з такого привабливого числа структурних елементів як, скажімо, 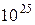 , та й означення моля доводиться прив’язувати до того самого нукліда
, та й означення моля доводиться прив’язувати до того самого нукліда 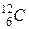 , що і у випадку з уведенням атомної одиниці маси. Отже, тепер має бути зрозумілим, як пов’язані між собою такі фізичні сталі, як
, що і у випадку з уведенням атомної одиниці маси. Отже, тепер має бути зрозумілим, як пов’язані між собою такі фізичні сталі, як  і а.о.м., не дивлячись на те, що у Державному стандарті [66] вони проходять як незалежні. Для тих, хто ще не збагнув, у чому полягає зв’язок, про який ідеться, — підказка: знайдіть добуток числових значень цих сталих і отримайте напрочуд “красиве” число.
і а.о.м., не дивлячись на те, що у Державному стандарті [66] вони проходять як незалежні. Для тих, хто ще не збагнув, у чому полягає зв’язок, про який ідеться, — підказка: знайдіть добуток числових значень цих сталих і отримайте напрочуд “красиве” число.
До відома:
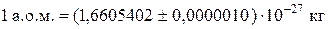 ;
;
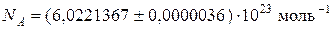 .
.
Запитання для роздумів: 1) Як згадати, як перевести атомні одиниці маси у кілограми, якщо Ви добре пам’ятаєте числове значення сталої Авогадро? 2) У Державному стандарті для всіх фундаментальних фізичних сталих,за винятком атомної одиниці маси (уніфікованої), наведені позначення у вигляді латинських або грецьких букв (можливо з індексами). На цьому тлі явно вирізняється позначення “а.о.м.”. А яке б позначення запропонували Ви? Порівняйте його з тим, що використовується у довіднику “Фізичні величини” [217]. 3) Чому у стандарті для атомної одиниці маси вводять пояснювальне слово “уніфікована”? А які ще бувають атомні одиниці маси?
Для наочності основний розглянутий нами навчальний матеріал поданий у вигляді схеми на рис. 2.30.
Запитання для роздумів до схеми: 1) Що означають фігурні дужки та індекси у таких позначеннях як 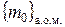 ? 2) Як розуміти наведений запис числового значення сталої Авогадро?
? 2) Як розуміти наведений запис числового значення сталої Авогадро?

 В учнів під час роботи над запитаннями є можливість спиратися як на текст, так і на схему. В такий спосіб враховані індивідуальні уподобання учнів щодо способу сприйняття і переробки інформації, про які йшлося у 1.4.
В учнів під час роботи над запитаннями є можливість спиратися як на текст, так і на схему. В такий спосіб враховані індивідуальні уподобання учнів щодо способу сприйняття і переробки інформації, про які йшлося у 1.4.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 616; Нарушение авторских прав?; Мы поможем в написании вашей работы!