
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пути интенсификации сжигания мазута
|
|
|
|
Лекция №7
- распыление на мелкие капли (dк < 500мкм);
- предварительный нагрев;
- высокие t в топке > 1500ºС;
- активное внедрение окислителя в корень факела.
Горение газового топлива.
При горении из компонентов СО, Н2 и СН4 образуются СО2 и Н2О. Академик Семенов разработал учение о цепных разветвленных реакциях согласно которому образуются промежуточные осколки, дающие начало новым реакциям.
Причины образования активных центров.
 Н2 + О2 = > ОН– + ОН–
Н2 + О2 = > ОН– + ОН– Н2 + м = > Н + + Н + + м
Н2 + м = > Н + + Н + + м
м – азот и т.п.- Н2О = > ОН– + Н +
Горение водорода.
Реакция горения:
2Н2 + О2 = 2Н2О (Еактивации = 550,  ; tвоспл = 550ºС)
; tвоспл = 550ºС)
Н + + О2 = > 3Н + + 2Н2О
Горение оксида углерода.
2СО + О2 = > 2СО2 (Еактивации = 100,  ; tвоспл = 600ºС)
; tвоспл = 600ºС)
При t < 700 ºС Н2О = > ОН– + Н + , а
СО2
 СО + ОН–
СО + ОН–
 Н + + О2
Н + + О2
Горение метана.
СН4 + 2О2 = СО2 + 2Н2О (Еактивации = 150,  ; tвоспл = 630ºС)
; tвоспл = 630ºС)
Особенности:
Горит в две стадии:
а) приготовление топливной смеси ее нагрев до tвоспл;
б)воспламенение и горение;
При t = 300 – 400 ºС идет пиролиз – процесс термического разложения с последовательным отщеплением Н2 и образованием сажи:
С2Н6 = > С2Н4 + Н2
С2Н4 = > С2Н2 + Н2
С2Н2 = > 2С + Н2

 Для исключения сажеобразования организуют предварительное смешивание топлива с окислителем:
Для исключения сажеобразования организуют предварительное смешивание топлива с окислителем:
СН4 + О2 = > СН3 + Н + + О2
Н + + О2 = > ОН– + О + 2
 СО
СО
 СН + ОН = > СН2О
СН + ОН = > СН2О
Н2
Пути интенсификации сжигания природного газа:
- деление топлива на тонкие струи со скоростью 50–100, м/с;
- активное смесеобразование до фронта горения;
- турбулизация воздушным потоком при скорости Wвозд = 35–45, м/с.
Энтальпия продуктов сгорания.
J = C.V.  ,
,  для твердого и жидкого топлива,
для твердого и жидкого топлива, 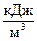 для газового топлива.
для газового топлива.
- При α = 1 VГº = VRO2 + VºH2O + VºN2

Для высокозольных топлив дополнительно учитывают энтальпию золы

JГ

JºГ
αT”
αпе”
αэк”
αух
 , ºС
, ºС
- при α > 1 VГ = VГº + ∆VB

Тепловой баланс котла.
Он характеризует распределение теплоты, вносимой в топку, на полезно используемую и тепловые потери.
 ,
, 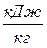 (
(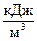 ), где
), где
Qрр – располагаемая теплота топлива;
Q1 – полезно используемая теплота;
Q2 – потери теплоты с уходящими газами;
Q3 – потеря теплоты от химической неполноты сгорания топлива;
Q4 – потеря теплоты от механической неполноты сгорания топлива;
Q5 – потери теплоты от наружного охлаждения котла;
Q6 – потери теплоты с физической теплотой шлака.
Если  , то q1 + q2 + q3 + q4 + q5 + q6 = 100%.
, то q1 + q2 + q3 + q4 + q5 + q6 = 100%.
Располагаемая теплота топлива.
Такой теплотой называется, та теплота, которой топливо располагает при сжигании.

 – теплота сгорания. Является функцией состава топлива;
– теплота сгорания. Является функцией состава топлива; – физическая теплота топлива
– физическая теплота топлива
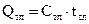 , где
, где  (для углей) или
(для углей) или  (для мазута);
(для мазута);
 – теплота, вносимая в топку с воздухом при его нагреве.
– теплота, вносимая в топку с воздухом при его нагреве.

 – теплота, вносимая в топку с паром при паровом распылении мазута
– теплота, вносимая в топку с паром при паровом распылении мазута
 , где σпар = 0, 3 – 0, 35,
, где σпар = 0, 3 – 0, 35,  – относительный расход пара на распыление мазута;
– относительный расход пара на распыление мазута; – теплота, расходуемая на разложение карбонатов при сжигании высокозольных топлив
– теплота, расходуемая на разложение карбонатов при сжигании высокозольных топлив
СаСО3 = > CаО + СО2– Qкарб
Qкарб = 40(СО2)ркарб.
Полезно используемая теплота.
Это та теплота, которая расходуется на нагрев воды, парообразование и перегрев пара.
 Dпр– расход продувочной воды для вывода части солей с целью предотвращения накипеобразования.
Dпр– расход продувочной воды для вывода части солей с целью предотвращения накипеобразования.

При слоевом сжигании угля q1 = 80%, а при сжигании мазута и природного газа q1 = 94%.
Потери тепла с уходящими газами.
Это та теплота, которую газы уносят через трубу в атмосферу при t = 120–170ºС. 
Факторы, влияющие на потерю теплоты с уходящими газами.
1. температура уходящих газов
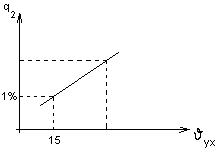
Для снижения υух размещают дополнительные поверхности нагрева.
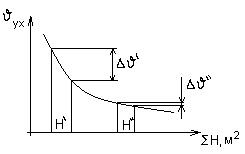 В области низких температур, даже незначительное снижение υух требует значительного количества поверхностей нагрева, поэтому оптимальную υух определяют технико-экономическими расчетами.
В области низких температур, даже незначительное снижение υух требует значительного количества поверхностей нагрева, поэтому оптимальную υух определяют технико-экономическими расчетами.
С ростом υух, растет J2, а значит, снижается КПД, поэтому растет В, а значит и затраты на топливо.
Для снижения υух, требуется увеличение Ннагр, что требует денежных затрат.

- Присос холодного воздуха

С ростом ∆α, растет объем и температура уходящих газов, соответственно возрастает их энтальпия, а значит, растет потеря с теплотой уходящих газов.
- Влажность топлива.
С ростом влажности, растет содержание воды в топливе, а значит, растет q2. - Загрязнение поверхностей нагрева.
С увеличением толщины загрязненного слоя снижается коэффициент теплопередачи k, снижается Qотд, растет υух = > растет q2. - паропроизводительность котла.

С ростом D, растет Qвыд пропорционально D1.
С ростом D, растет Qотд пропорционально Dº.6.
Меры борьбы с q2:
- чистота поверхностей нагрева;
- устранение присосов.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!