
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Л Е К Ц И Я. Таким образом, достаточным основанием какой-либо мысли может быть любая другая, уже проверенная и установленная мысль
|
|
|
|
Таким образом, достаточным основанием какой-либо мысли может быть любая другая, уже проверенная и установленная мысль, из которой с необходимостью вытекает истинность данной мысли.
Если из истинности суждения а следует истинность суждения b, то а будет основанием для b, а b — следствием этого основания.
Связь основания и следствия может быть выражена при помощи импликации р à q, где р — основание, q — следствие. В некоторых случаях основание, в свою очередь, нуждается в обосновании своей истинности. Если, например, суждение z обосновывается при помощи суждения q, которое, в свою очередь, обосновывается суждением р, то перед нами цепь суждений, связанных друг с другом следующим образом: (p à q) Λ (q à z).
Связь основания и следствия является отражением в мышлении объективных, в том числе причинно-следственных связей, которые выражаются в том, что одно явление (причина) порождает другое явление (следствие). Однако это отражение не является непосредственным. В некоторых случаях логическое основание может совпадать с причиной явления (если, например, мысль о том, что число дорожно-транспортных происшествий увеличилось, обосновывается указанием на причину этого явления — гололед на дорогах). Но чаще всего такого совпадения нет. Суждение «Недавно был дождь» можно обосновать суждением «Крыши домов мокрые»; след протекторов автомобильных шин — достаточное основание суждения «В данном месте прошла автомашина». Между тем мокрые крыши и след, оставленный автомашиной, — не причина, а следствие указанных явлений. Поэтому логическую связь между основанием и следствием необходимо отличать от причинно-следственной связи.
Обоснованность — важнейшее свойство логического мышления. Во всех случаях, когда мы утверждаем что-либо, убеждаем в чем-либо других, мы должны доказывать наши суждения, приводить достаточные основания, подтверждающие истинность наших мыслей. В этом состоит коренное отличие научного мышления от мышления ненаучного, которое характеризуется бездоказательностью, способностью принимать на веру различные положения и догмы. Это особенно характерно для религиозного мышления, опирающегося не на доказательство, а на веру.
Закон достаточного основания несовместим с различными предрассудками и суевериями. Например, существуют нелепые приметы: разбить зеркало — к несчастью, рассыпать соль — к ссоре и т. д., хотя между разбитым зеркалом и несчастьем, рассыпанной солью и ссорой нет причинной связи. Логика — враг суеверий и предрассудков. Она требует обоснованности суждений и несовместима поэтому с утверждениями, которые строятся по схеме «после этого — значит, по причине этого». Эта логическая ошибка возникает в случаях, когда причинная связь смешивается с простой последовательностью во времени, когда предшествующее явление принимается за его причину.
В работе «Суеверия и правила логики» Н.Г.Чернышевский приводит такой пример. Древние римляне видели ворону, которая каркала справа, и проиграли битву; в следующий раз ворона каркала слева, и они выиграли битву. Из этих фактов римляне сделали вывод, что карканье вороны с правой стороны приносит войску поражение, а карканье с левой стороны — победу. Разоблачая суеверия, Чернышевский пишет, что привычку делать заключения по форме «после этого, — следовательно, по причине этого» логика требует заменить исследованием положительных причин.
Закон достаточного основания имеет важное теоретическое и практическое значение. Фиксируя внимание на суждениях, обосновывающих истинность выдвинутых положений, этот закон помогает отделить истинное от ложного и прийти к верному выводу.
Значение закона достаточного основания в юридической практике состоит, в частности, в следующем. Всякий вывод суда или следствия должен быть обоснован. В материалах по поводу какого-либо дела, содержащих, например, утверждение о виновности обвиняемого, должны быть данные, являющиеся достаточным основанием обвинения. В противном случае обвинение не может быть признано правильным. Вынесение мотивированного приговора или решения суда во всех, без исключения, случаях является важнейшим принципом процессуального права.
В логических исчислениях законы мышления: тождества (р à р), непротиворечия (┐(р Λ ┐р)), исключенного третьего (р v ┐ р) рассматриваются как тождественно-истинные высказывания, или логические тавтологии, которые являются истинными при любых значениях переменных.
К логически истинным высказываниям относится множество других выражений, которые принято называть логическими законами. Примерами таких законов являются следующие.
Закон двойного отрицания: ┐┐р = р — двойное отрицание некоторого высказывания эквивалентно утверждению этого высказывания.
Закон контрапозиции: (p à q) = (┐q->┐p) — если из высказывания р следует высказывание q, то и из отрицания высказывания q следует отрицание высказывания р.
Законы де Моргана:
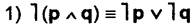
|
— отрицание конъюнкции эквивалентно дизъюнкции отрицаний;
— отрицание дизъюнкции эквивалентно конъюнкции отрицаний.
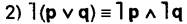
|
В практике обычных рассуждений законы логики — тождества, непротиворечия, исключенного третьего и достаточного основания выполняют функцию принципиальных условий правильного, логического мышления. Логические тавтологии, или всегда истинные высказывания, условно именуемые также логическими законами, играют иную роль. В логических исчислениях они рассматриваются как всегда истинные, не требующие специального доказательства выражения, с помощью которых упрощаются логические преобразования и тем самым ускоряется решение задач по определению правильности логического следования, доказательства, поиску гипотез и т.п.
Для правильного понимания законов формальной логики важно отметить следующее.
Окружающий нас мир, предметы и явления действительности находятся в процессе постоянного движения, изменения, развития. И это необходимо учитывать в познании. Диалектика вещей отражается в диалектике мышления. Законы тождества, непротиворечия, исключенного третьего, являясь своеобразным отражением качественной определенности вещей, относительной устойчивости их свойств, не являются законами познания диалектики вещей, она познается с помощью законов диалектической логики. Но это не значит, что формально-логические законы противоречат законам диалектической логики. Познавая изменяющийся предмет, необходимо мыслить его в понятии с определенным, устойчивым содержанием, фиксируя его относительно устойчивые свойства. Формальная логика оперирует сложившимися понятиями, отвлекаясь от изменения и развития понятий и отражаемых ими предметов.
Выражая непротиворечивость, последовательность мышления, законы непротиворечия и исключенного третьего не «запрещают» диалектических противоречий, свойственных как объективному миру, так и мышлению человека. Нарушения вытекающих из них требований затрудняют познание действительности, в том числе познание диалектических противоречий.
Определенность, непротиворечивость, последовательность, обоснованность — коренные свойства любого мышления, не исключая диалектического.
Контрольные вопросы
1. Какие свойства логического мышления выражают основные формально-логические законы?
2. Что выражает закон тождества, какова его роль в процессе рассуждения?
3. В чем сущность закона непротиворечия и какова его роль в познании?
4. Что выражает закон исключенного третьего, в отношении каких суждений он действует?
5. В чем смысл и значение закона достаточного основания?
6. Охарактеризуйте роль основных формально-логических законов в работе журналиста и специалиста-международника..
по нейрохирургии
на тему № 2
«Поражения сосудов головного мозга»
для слушателей цикла «Актуальные вопросы нейрохирургии»
Обсуждена и одобрена
на заседании кафедры
Протокол №___
От «___»___________2008 г.
Уточнена (дополнена)
“____”___________200__ г.
________________________
(подпись, фамилия, и.,о.)
Санкт-Петербург
СОДЕРЖАНИЕ
| № | Учебные вопросы | Время |
| 1. | Введение | |
| 2. | Артериальные аневризмы | |
| 3. | Артерио-венозные соустья | |
| 4. | Геморрагический инсульт | |
| 5. | Заключение |
ЛИТЕРАТУРА
Использованная при подготовке текста лекции:
1. Б.В. Гайдар. Практическая нейрохирургия. Руководство для врачей. – СПб, «Гиппократ», 2002. – 647с.
2. В.Е. Парфёнов, Д.В. Свистов. Лекции по нейрохирургии. – СПб, «Фолиант», 2004. – 336с.
3. Триумфов А.В. Топическая диагностика заболеваний нервной системы. 1974, 2003.
4. Лебедев В.В., Быковников Л.Д. Руководство по неотложной нейрохирургии. М., 1987 г.
5. Хилько В.А., Зубков Ю.Н. Внутрисосудистая нейрохирургия. - Л., Медицина, 1982 г.
6. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга./ Труфанов Г.Е, Рамешвили Т.Е., Фокин В.А., Свистов Д.В.Руководство для врачей. «ЭЛБИ-СПб» СПб., 2006, 224 с.
7. Транскраниальная допплерография в нейрохирургии. (методическое пособие) Методическое пособие/ Главное Воен.-мед. упр. МО РФ, Воен.-мед. акад. - СПб.: ВМедА, 2000.-69с.
Артериальные аневризмы
Аневризмы (местное расширение просвета артерии вследствие изменения или повреждения её стенки) головного мозга являются основной причиной нетравматического субарахноидального кровоизлияния. По данным патологоанатомических вскрытий аневризмы обнаруживаются в 2-5% случаев, что свидетельствует о том, что в популяции доминируют неразорвавшиеся аневризмы, число которых превышает апоплексические в 500 раз.
Аневризмы головного мозга представляют собой приобретенный фактор риска нарушения мозгового кровообращения по геморрагическому (90%), реже по ишемическому (10%) типу. Международное исследование, проведенное Pakarinen (1967), дало следующие результаты. Смертность после первого кровоизлияния из аневризм достигает 43%, после второго - 64%, после третьего - 86%. Из тех больных, которые выжили после первого субарахноидального кровоизлияния, 35% погибают в течение первого года, а в течение второго-пятого года умирают, примерно по 5% в год. К этим, поистине печальным, цифрам летальности следует добавить, что 30% больных, которым удалось выжить, остаются инвалидами полностью или частично.
Многолетние патологоанатомические исследования, позволили доказать сегментарное строение мышечного аппарата артериального круга мозга. Соединение сегментов осуществляется посредством специализированного связочного аппарата, представленного фиброзно-эластическим кольцом. Аневризма формируется на почве растяжения сочленения сегментов вследствие гемодинамических причин, что позволяет говорить об их приобретенной природе. Темп формирования аневризм неизвестен.
Аневризмы подразделяют по топографоанатомическому признаку и размерам. Частота поражений магистральных артерий мозга неодинакова. 85-95% аневризм локализуются в каротидном бассейне: передняя соединительная артерия (30%), задняя соединительная артерия (25%), средняя мозговая артерия (20%). 5-15% аневризм локализуются в вертебро-базилярном бассейне: бифуркация основной артерии, верхняя мозжечковая артерия, слияние позвоночных артерий (10%), позвоночная артерия (5%).
После внедрения в нейрохирургическую практику обязательной ангиографии всех церебральных сосудистых бассейнов стали чаще обнаруживаться множественные аневризмы, встречающиеся в 20% случаев (из них в 15% - по две аневризмы; в 3,5% - по три; а в 1,5% - четыре аневризмы).
По размерам аневризматического мешка выделяют милиарные аневризмы (линейный размер менее 3 мм); обычные или среднего размера (4-15 мм); крупные (16-25 мм) и гигантские (более 25 мм).
По форме аневризматического мешка выделяют мешотчатые (имеют шейку, тело и дно) и фузиформные (равномерное или эксцентричное расширение артерии).
По клиническому течению аневризмы подразделяют на три основные группы:
1) разорвавшиеся (апоплексическая форма), сопровождающиеся субарахноидальным или другим видом кровоизлияния (до 90,4% аневризм)
2) неразорвавшиеся (паралитическая форма), проявляюшиеся поражением головного мозга и черепных нервов (до 9,6% от общего количества аневризм);
3) случайно обнаруживаемые (бессимптомные) на секции или при ангиографии.
Риск разрыва аневризм составляет до 1.9% в год. При этом, частота разрывов аневризм диаметром менее 10 мм составляет всего 0.05% в год, тогда как множественных – 6.8%. Широкое применение в последние годы методов минимально-инвазивной диагностики позволило проводить скрининговые обследования населения в целях выявления и раннего хирургического лечения неразорвавшихся аневризм. Установлено, что факторами риска формирования и разрыва аневризм являются те же, что и для атеросклероза (курение, артериальная гипертензия, сахарный диабет), но экономически оправданным является скрининг (одно обследование в пять лет) следующих групп:
- пациенты с генетическими синдромами, связанными с риском субарахноидального кровоизлияния (синдром Элерса-Данло IV типа и аутосомно-доминантный поликистоз почек);
- родственники больных с симптомными аневризмами (факт аневризматического кровоизлияния у «кровных» родственников повышает риск кровоизлияния до 2 до 5% в течение второго-седьмого десятилетий жизни; частота неразорвавшихся аневризм у них составляет 8%);
- пациенты, перенесшие аневризматическое кровоизлияние в возрасте до 40 лет (частота формирования аневризм de novо у них составляет 2% в год).
В клиническом течении разорвавшихся артериальных аневризм целесообразно рассматривать три периода: догеморрагический, геморрагический и постгеморрагический.
I период (догеморрагический) обычно протекает бессимптомно и субарахноидальное кровоизлияние является первым проявлением заболевания. У незначительной части больных могут отмечаться головные боли, которые чаще связывают с гипертонической болезнью или атеросклерозом мозговых сосудов, и лишь в единичных случаях наличие офтальмоплегии позволяет заподозрить аневризму в догеморрагический период, кроме того, необходимо помнить, что офтальмоплегическая форма мигрени в 10% случаев обусловлена наличием аневризм сосудов головного мозга.
II период (геморрагический) начинается с момента разрыва аневризмы и, обычно, продолжается до 2-3 нед. - до санации ликвора. Как правило, первое кровоизлияние наступает внезапно, среди полного здоровья. Появляется резкая головная боль, которую больные характеризуют как "удар по голове", затем тошнота, многократная рвота, общая слабость. Примерно в 23% случаев субарахноидальное кровоизлияние сопровождается потерей сознания и в 3% - эпилептическим припадком. Менингеальные симптомы обнаруживаются почти во всех случаях, лишь изредка на фоне коматозного состояния менингеальный симптомокомплекс может не выявляться. Очаговые симптомы при первом субарахноидальном кровоизлиянии наблюдаются в 50% случаев: анизокория - у 19%; поражение глазодвигательных нервов - у 16%; гемипарез или гемиплегия - у 22%; нарушения речи - у 5%. Очаговые полушарные симптомы в большинстве случаев связаны с церебральным вазоспазмом, лишь в единичных случаях обусловлены внутримозговым кровоизлиянием. Психические расстройства характеризуются чаще типичными "лобными" нарушениями и отмечаются в 10% случаев; диэнцефальная симптоматика - в 5%.
В III периоде (постгеморрагическом) по клиническому течению выделяют три основные группы больных. В первой из них, после геморрагического периода, сохраняются различные очаговые и общемозговые симптомы: поражение глазодвигательных нервов, нарушения речи, движений и чувствительности, головные боли, снижение памяти, интеллекта, работоспособности или стойкие психические нарушения. Для второй группы характерны повторные кровоизлияния, наступающие через несколько месяцев, а иногда и через несколько лет. В третьей группе длительное время не отмечается каких-либо клинических проявлений аневризмы, у них сохраняется трудоспособность, однако постоянно существует опасность повторного кровоизлияния (если не наступил спонтанный тромбоз аневризмы), которое может повториться через 10 лет и более после первой геморрагии.
Неразорвавшиеся аневризмы проявляют себя различными очаговыми симптомами поражения головного мозга и черепных нервов. Так, псевдотуморозное течение отмечается в 92.6% аневризм кавернозного отдела ВСА. Основным неврологическим синдромом является синдром кавернозного синуса (96.3%), включающий в себя совокупность симптомов поражения III-VI черепных нервов, экзофтальм. Дебют связан с ремитирующим офтальмопарезом, проявляющимся преходящей диплопией, птозом. В дальнейшем развивается тотальная офтальмоплегия, хронический тригеминальный болевой синдром. Иногда заболевание начинается остро с приступа локальной головной боли в лобно-височной и/или лицевой области, вслед за которым развивается офтальмопарез.
Основой установления диагноза аневризматической болезни мозга являются методы лучевой диагностики, позволяющие выявить и определить основные черты внутричерепного кровоизлияния и его причины.
Диагностика аневризм, как источника САК, имеет своей целью:
1) выявление аневризмы,
2) определение несущего сосуда и расположения шейки (устья) аневризмы,
3) оценку размеров, положения и направления купола аневризмы и шейки,
4) выявление внутрипросветных тромбов в полости аневризмы,
5) определение отношения к костным структурам черепа,
6) оценку состояния головного мозга и ликворосодержащих пространств,
7) определение возможности применения того или иного вида лечения в зависимости от особенностей строения,
8) планирование и моделирование хирургической коррекции.
С диагностической целью могут использоваться следующие лучевые методы: краниография, церебральная ангиография, компьютерная томография, магнитно-резонансная томография, ультразвуковые методы. Ведущее значение в диагностике аневризм продолжает играть церебральная ангиография, которая остается «золотым стандартом» диагностики аневризматической болезни, обладая наивысшей точностью. Риск ангиографического исследования невелик в сравнении с риском неконтролируемого развития событий при повторных разрывах недиагностированных аневризм. Рутинно, при подозрении на аневризматическое САК, выполняют «четырехсосудистую» церебральную панагиографию, т.е. контрастируют сосудистые бассейны обеих сонных и позвоночных артерий. В остром периоде САК аневризмы выявляют в 50.4-80% случаев. При не выявлении аневризм, исследование проводят повторно через 3-14 суток, что позволяет в 2% наблюдений обнаружить ранее тромбированные аневризмы. Неоценимо значение ангиографии в диагностике множественных аневризм. Признаками разорвавшейся аневризмы могут быть:
- неровные контуры аневризмы, частично тромбированной после разрыва;
- спазм магистральных сегментов мозговых артерии по соседству с разорвавшейся аневризмой;
- смещение сосудов, несущих аневризму, паренхиматозной гематомой (симптом «ухвата»);
- при множественных аневризмах разорвавшаяся аневризма, как правило, имеет больший размер.
Для полноценной визуализации аневризмы и выявления всех аспектов анатомического строения необходимо использовать не только стандартные (боковую и передне-заднюю проекции), но и ряд атипичных укладок, в т.ч. «косые», позволяющие вывести шейку и тело аневризм в оптимальной проекции.
Помимо выявления аневризм церебральная ангиография позволяет оценить факт наличия и степень смещения магистральных сосудов при латеральной дислокации мозга и паренхиматозных кровоизлияниях. Ангиография высокоинформативна в оценке состояния коллатерального кровоснабжения мозга, особенно в тех случаях, когда планируется проведение деструктивных вмешательств. Наконец, церебральная ангиография может быть логично объединена с рентген-интервенционными вмешательствами на аневризме.
В связи с тем, что в 19% наблюдений после операций на аневризме обнаруживаются различные дефекты и осложнения (оставшиеся аневризмы, неклипированные аневризмы, окклюзии магистральных сосудов), нередко остающиеся малосимптомными, за исключением клипирования магистральных артерий, церебральная ангиография является обязательным методом послеоперационного контроля.
Крайне неблагоприятный прогноз при консервативном лечении больных с разорвавшимися аневризмами обусловливает необходимость применения хирургических методов лечения. По данным S. De la Monte (1985), около 60-87% больных после первого разрыва аневризмы погибают в сроки от 1 до 6 мес. При этом, 60% в первые сутки; 26,3% - на 2-3-и; 7,7% - на 4-7-е; 3,5% - на 8-21 сутки и 2,5% - 22-60-е сутки после разрыва (Alvord Е. et al., 1971). Кроме дислокационных, ишемических процессов, возникающих после первого разрыва аневризм, одним из основных факторов летальности является повторное кровотечение. Мероприятия режима и медикаментозной терапии не гарантируют от повторного разрыва.
Наиболее радикальным способом повторных аневризматических кровоизлияний является выключение аневризмы из кровообращения, что достижимо хирургическим путем. Первый опыт хирургического лечения аневризм относится к 1886 году, когда Horsley перевязал общую сонную артерию. Первая внутричерепная операция выполнена Dott (1931) по поводу разорвавшейся аневризмы бифуркации внутренней сонной артерии. Аневризма была окутана мышечным лоскутом. Пациент прожил после операции 11 лет и умер в возрасте 64 лет от инфаркта миокарда.
В шестидесятых годах были изобретены самозажимающиеся съемные пружинные клипсы, положение которых стало возможным изменять после наложения. К семидесятым годам XX века усилиями ряда выдающихся нейрохирургов (C.Drake, M.Yasargil) были разработаны принципы оперативной микронейрохирургии, позволяющие выполнять реконструктивные независимо от локализации, размеров и формы аневризмы.
По данным Лебедева В.В. с соавт. (1996) операции на аневризмах могут быть предприняты в различные сроки после САК и, соответственно, разделены на:
- ранние (в первые 72 ч с момента САК);
- ранние отсроченные (на 4-7-е сутки);
- отсроченные (на 8-14-е сутки);
- поздние отсроченные (на 15-21-е сутки);
- поздние операции, проводимые в “холодном” периоде (после 22-х суток).
По данным сводной статистики, послеоперационная летальность при операциях в первые 14 суток составляет 16%. При этом показатель летальности был тесно связан с фактором тяжести состояния больных на момент операции и сроком операции.
Показатели летальности (%) после операций
по поводу аневризм в сроки до 14 сут.
| Тяжесть состояния по Hunt&Hess | Сроки операций, сутки | |||
| 1-3 | 4-7 | 8-14 | 1-14 | |
| I-II | 3,8 | 3,5 | 1,5 | |
| III-IV | 25,5 | 25,5 | ||
| V | 71,5 | |||
| Всего | 16,5 |
Результаты свидетельствуют о том, что раннее хирургическое выключение аневризм из кровообращения показано при тяжести состояния I-II степени. Хирургическое лечение пациентов при степени тяжести V малоперспективно, за исключением первых 3 суток, когда операция рассматривается как реанимационное мероприятие, и направлено на ликвидацию острого дислокационного и гипертензионного синдромов. Выбор хирургической тактики у больных с III-IV степенью тяжести состояния является наиболее сложным. Решение должно приниматься с учетом наличия и выраженности вазоспазма, характера внутричерепного кровоизлияния, возраста больного.
В.В.Лебедевым с соавт. (1996) предложена схема рекомендуемого объема хирургических вмешательств в остром периоде САК в зависимости от срока операции и характера кровоизлияния.
| Характер кровоизлияния | Объем операций при различных сроках САК, сутки. | |
| 1-3-е | 4-7-е | 8-14-е |
| САК | Клипирование аневризмы (А) при I-III степени тяжести. | Клипирование А при I-II степени тяжести. При III-IV тактика зависит от осложнений. V степень - хирургическое лечение не показано |
| САК+ВЧГ САК+ВЧГ+ВЖК | Удаление ВЧГ и клипирование А при установлении диагноза при I-V степени (При IV-V степени. клипирование А только при отсутствии дополнительной травмы мозга). Удаление свертков крови из желудочков, жренирование желудочков. | |
| САК+ЦВ | Клипирование А при I-II степени при отсутствии грубых изменений на ЭЭГ, При III-IV степени и грубых изменениях на ЭЭГ, при V степени операция нецелесообразна | Клипирование А при I-III степени и отсутствии грубых изменений на ЭЭГ. Операция не показана при III-V степени тяжести и грубых изменениях на ЭЭГ |
| САК+ВЖК САК+ВЖК+ЦВ | Клипирование А при I-III степени тяжести и устранение гемотампонады. При IV-V степени - дренирование желудочков. | Клипирование аневризмы А при I-III степени тяжести и устранение гемотампонады. При IV можно ограничиться устранением гемотампонады. При V степени - не показана. |
| САК+ВЧГ+ЦВ | Удаление ВЧГ и клипирование А при установлении диагноза при I-V степени независимо от выраженности ЦВ |
ВЧГ – внутричерепная гематома
ВЖК – внутрижелудочковое кровоизлияние
ЦВ – церебральный вазоспазм
Показаниями к хирургическому лечению аневризм является:
n история аневризматического внутричерепного кровоизлияния;
n клиника поражения черепных нервов;
n эпизоды нарушения мозгового кровообращения вследствие тромбоэмболии из полости аневризмы;
n прогрессирующим увеличением размера аневризм;
n неразорвавшиеся аневризмы размером более 10 мм.
Хирургическое лечение включает несколько методов оперативных вмешательств, целью которых является облитерация аневризмы:
Внутричерепные вмешательства:
- клипирование аневризмы;
- клипирование несущего аневризму сосуда;
Внутрисосудистые вмешательства:
- окклюзия полости аневризмы отделяемым баллоном;
- окклюзия полости аневризмы микроспиралями;
- окклюзия несущего аневризму сосуда;
- ангиопластика при церебральном вазоспазме.
При невозможности радикального вмешательства предпринимают паллиативные вмешательства, направленные на предупреждение повторных разрывов аневризм.
Целью открытого внутричерепного вмешательства на аневризме является выключение ёе из кровотока при сохранности проходимости несущего и окружающих сосудов, включая перфорантные артерии; удаление жидкой крови и свертков крови из субарахноидальных щелей и паренхимы мозга; устранение гемотампонады желудочков мозга. Операции на аневризмах головного мозга относятся к разряду одних из наиболее сложных в нейрохирургии. Операция должна быть минимально травматичной, что обеспечивается выполнением оптимальных хирургических доступов, микрохирургической техники, щадящей тракции мозга, сохранением перфорантных и соединительных артерий, одномоментным клипированием шейки аневризмы, тщательным гемостазом.
Для выполнения операций используется операционный микроскоп, специальные микрохирургические инструменты для диссекции аневризм и образований основания мозга, самозажимающиеся микрохирургические клипсы. Проведение операции должно сопровождаться соблюдением ряда принципов:
- специальное анестезиологическое сопровождение (профилактика колебаний перфузионного давления на этапах вводной анестезии, интубации основного этапа и выхода из анестезии);
- обеспечение медикаментозного и механического релапса мозга;
- обеспечение достаточного операционного поля для атравматичных манипуляций на аневризме;
- адекватное освещение и оптическое увеличение операционного поля;
- наличие соответствующего инструментария и клипс.
При доступе к аневризмам передних отделах артериального круга применяют птериональный, субфронтальный или межполушарный доступы. При аневризмах вертебро-базилярного бассейна – подвисочный, субокципитальный и другие доступы, связанные с резекцией образования основания черепа. Все доступы характеризуются тем, что на ранних этапах выделения аневризмы производится широкое вскрытие арахноидальных пластин основания мозга, формирующих ликворные цистерны, что позволяет эвакуировать ликвор и добиться релапса мозга. Препаровка магистральных сосудов артериального круга начинается с проксимальных сегментов, что позволяет обеспечить «проксимальный» контроль, использовать наложение временного клипса при интраоперационном разрыве аневризмы. Клипирование шейки осуществляют таким образом, чтобы клипс не деформировал или перекрывал просвет магистральных сосудов и их ветвей.
По иронии судьбы зарождение внутрисосудистых операций по поводу аневризм произошло на век раньше первых открытых операций. Независимо друг от друга Velpeu (1831) и Phillips (1832) описали индукцию тромбоза артерий путем установки в ее просвет иглы. Оба автора полагали, что этот метод применим в хирургии аневризм. Ciniselli (1847) для тромбирования аневризм предложил пропускать через иглу электрический ток. В 1864 Moore and Murchison описали метод лечения иноперабельных аневризм путем размещения в ее просвете проволоки. В 1941 году Werner описал успешное электротермическое тромбирование внутричерепной аневризмы путем заполнения ее серебряной проволокой. Всемирно признанным пионером внутрисосудистой хирургии аневризм стал отечественный нейрохирург академик РАМН Ф.А. Сербиненко, предложивший в 1971 году оригинальный микробаллон-катетер, позволявший осуществлять суперселективную катетеризацию мозговых артерий и аневризм. Метод не лишен ряда недостатков (трудности навигации, невозможность применения проводников, несоответствие формы и размеров баллона аневризме, частые реканализации и увеличение размеров аневризмы), в связи с чем сегодня преимущественно применяется для лечения крупных, гигантских и фузиформных аневризм. Существенный прогресс в баллонной хирургии аневризм обусловили исследования, выполненные Ю.Н.Зубковым (разработал методику баллонной ангиопластики артерий мозга при церебральном вазоспазме) и В.И.Щегловым (разработал оригинальную конструкцию баллон-катетеров, позволяющих стационарно облитерировать аневризмы любых локализаций)
Эндовазальные операции с применением разделяемых баллон-катетеров подразделяются на реконструктивные (просвет артерии, несущей аневризму, сохраняется) и деструктивные (несущая артерия выключается вместе с аневризмой). Реконструктивные операции возможны при аневризмах малого, среднего и крупного размеров, с узкой шейкой. Попытки достичь реконструктивной баллон-окклюзии аневризм приводят к значительному количеству осложнений и технических неудач. Выключение аневризмы с окклюзией несущего сосуда отмечается в 13%, частичная окклюзия полости аневризмы в 14%, ишемические осложнения операций наблюдаются в 12%, разрывы аневризм – в 19%, летальные исходы наступили после 21% операций. При гигантских, частично тромбированных аневризмах, проявляющихся симптоматикой сдавления черепных нервов, показаны деструктивные вмешательства. Тромбирование аневризмы способствует уменьшению ее объема в 1.5-2 раза и регрессу очаговой симптоматики в 74.3%.
Проведение деструктивной операции при недостаточном коллатеральном кровоснабжении бассейна пораженной сонной артерии требует предварительного или одномоментного выполнения обходного шунта (экстра-интракраниального микрососудистого анастомоза). При гигантских аневризмах ВСА благоприятный результат был достигнут в 98% деструктивных операций и 90% комбинированных (баллон-окклюзия+ЭИКМА).
Следующим этапом внутрисосудистой хирургии стало применение микроспиралей для тромбирования полости аневризм. По-настоящему надежным этот способ лечения стал с предложением и широким внедрением в практику разделяемых микроспиралей. Наиболее прогрессивным продуктом новой технологии стали электролитически разделяемые платиновые микроспирали Guglielmi (GDC). Благодаря применению микроспиралей аневризма может быть выключена из циркуляции с сохранением проходимости несущей артерии, что более физиологично по сравнению с деструктивными баллон-окклюзиями.
Эмболизация микроспиралями рассматривается как метод выбора в лечении множественных аневризм. Наибольший эффект отмечается при использовании отделяемых микроспиралей в лечении аневризм малого размера, с узкой шейкой (соотношение диаметра аневризмы и ширины шейки должно быть не менее 1.5), в остром периоде кровоизлияния. Суммарный «технический» успех операции варьирует от 65% до 98% в зависимости от анатомической и клинической ситуации.
Несмотря на многие положительные моменты даже эта технология не применима при гигантских аневризмах, поражениях, имеющих сложную форму, широкую шейку. Для преодоления этих недостатков в последние годы применяют комбинацию из временной баллон-окклюзии сосуда, несущего аневризму, и эмболизации аневризмы микроспиралями. Баллон удерживает спираль в аневризме, формирует трехмерную структуру эмболизата. При фузиформных и сложных по анатомии аневризмах комбинируют гибкие внутрипросветные протезы артерий – стенты – и микроспирали, установленных в полость аневризмы через дефекты стенки протеза.
Таким образом, возможности современных методов диагностики и раннего хирургического лечения аневризматической болезни мозга достаточно широки, но они достижимы только в условиях специализированного нейрохирургического стационара, в связи с чем, для улучшения исходов лечения больных необходимо обеспечить:
- раннюю диагностику аневризматических внутричерепных кровоизлияний;
- адекватную интенсивную терапию аневризматических кровоизлияний;
- раннюю эвакуацию больных в сосудистый нейрохирургический стационар.
Принципы лечения пациентов
с артериовенозными мальформациями головного мозга.
Первые описания сосудистых мальформаций встречаются в медицинской литературе XVII века. Патологоанатомические исследования начаты в середине XIX века и связаны с именами Р.Вирхова, Е.Эсмарха, Х.Люшка и др. Но, несмотря на полуторавековую историю изучения, один из корифеев сосудистой нейрохирургии M.G.Yasargil в 1987 году признал, что «... пять аспектов, касающихся сосудистых мальформаций, по-прежнему остаются противоречивыми: патогенез, номенклатура, классификация, диагноз, лечение.»
Сегодня, по мнению ведущих патоморфологов, к порокам развития сосудов головного мозга (сосудистым мальформациям) следует относить гетерогенную группу дисэмбриогенетических образований ангиоматозного строения, персистирующие эмбриональные сосуды, различные шунты и фистулы. Суммарная частота ангиоматозных пороков развития составляет 19 случаев на 100000 населения в год.
Основными видами сосудистых мальформаций являются:
Кавернозный порок развития (caverna - пещера): скопление сосудистых полостей, разделенных общими перегородками (септами), выстланными эндотелием.
Рацемозный порок развития: между сосудистыми стволами, образующими ветвистый клубок, могут находиться структуры мозга или его оболочки.
Артериовенозные рацемозные мальформации (АВМ) не относятся к числу широко распространенных форм поражения сосудистой системы мозга. Они составляют от 1.5 до 4% от внутричерепных объемных процессов, являются причиной 8.6% субарахноидальных кровоизлияний нетравматической этиологии, 1% всех мозговых инсультов. Субарахноидальное кровоизлияние, вызванное АВМ встречается с частотой 1-3 случая на 100000 населения в год. Частота АВМ в популяции не известна, но можно прогнозировать ежегодную клиническую манифестацию АВМ у 2-6 человек на 100000 населения в год. В структуре клинически манифестных форм сосудистых мальформаций АВМ составляют до 75%. Половозрастная характеристика АВМ неспецифична: соотношение мужчин и женщин, по разным сводкам, колеблется от 1.09 до 1.91. Клиническая манифестация чаще всего наступает между вторым и пятым десятилетием жизни, то есть в период наибольшей трудовой и социальной активности, что говорит о значимости этой нозологической формы для практической медицины.
Несмотря на относительно более благоприятный вариант течения заболевания по сравнению с аневризматической болезнью отдаленный прогноз при консервативном лечении неблагоприятен: глубокая инвалидизация наступает у 48% носителей АВМ, а 23% больных погибают.
Типичные АВМ представлены тремя основными компонентами: приводящими артериями (афференты АВМ), клубком измененных сосудов (ядро) мальформации, дренирующими венами (эфференты АВМ). Для приводящих сосудов наиболее характерным является более или менее выраженное расширение просвета и удлинение, следствием чего является патологическая извитость и деформация магистральных артерий шеи, магистральных внутричерепных сосудов.
По степени участия в кровоснабжении АВМ питающие артерии могут быть как «концевыми» (кровь попадает только в мальформацию) так и «транзитными» или vessel en passage (отдавая ветви к мальформации артерия участвует в кровоснабжении нормального мозга).
Количество питающих артерий может быть различным: от одной (при мелких АВМ) до нескольких (при АВМ среднего и крупного размера). Основными источниками кровоснабжения АВМ являются ветви средней мозговой (38%), передней мозговой (10%), задней мозговой (7%) артерий, сосудов вертебро-базилярного бассейна (10%).
Ядро мальформации представляет собой клубок переплетенных сосудов различного калибра (от 100 до 3000 мкм), являющихся прямыми артериовенозными анастомозами без микроциркуляторного русла. Клубок АВМ может иметь форму шара, пирамиды или усеченной пирамиды, двояковыпуклой линзы, цилиндра. Ядро может располагаться как в субарахноидальном пространстве, так и в паренхиме мозга, паравентрикулярно. Описаны три основных анатомических варианта ядра АВМ: фистулезный (артерия непосредственно переходит в вену, как правило с выраженной эктазией переходного участка); ангиоматозный (связь артерий с венами осуществляется через клубок диспластических сосудов); сочетание редкого фистулезного варианта с ангиоматозным.
В участках мозга, окружающих и заключенных между сосудистыми петлями АВМ отмечаются выраженные дистрофические изменения, что является реакцией мозговой ткани на травмирующие пульсовые воздействия, кровоизлияния, хроническую недостаточность кровоснабжения.
Из клубка АВМ исходят аномально расширенные извитые вены. При этом нередко отмечается локальное расширение вен, напоминающее аневризму, - варикоз.
Одним из ведущих в проблеме изучения АВМ является вопрос о патогенезе нарушений мозгового кровообращения, обусловленных мальформацией. Основными механизмами патологического влияния АВМ на мозг являются внутричерепные кровоизлияния, вызванные разрывом патологических сосудов клубка или аневризм артерий, питающих АВМ и хроническая недостаточность кровообращения, вызванная артериовенозным шунтированием.
Источником кровоизлияний при АВМ чаще всего являются резко истонченные, варикозно расширенные вены. Реже - аневризмы, возникающие на питающих артериях как на значительном отдалении (в типичных участках артериального круга), так и в непосредственной близости от клубка или в самом ядре мальформации.
Анатомическая характеристика кровоизлияния из АВМ отличается от аневризматического тем, что значительно чаще встречаются паренхиматозные формы, нежели простое субарахноидальное. АВМ средней линии часто являются причиной вентрикулярных геморрагий. Темп кровотечения из АВМ ниже, чем из аневризмы, в связи с чем степень повреждающего влияния на мозг существенно меньше, тромбирование наступает относительно быстро, что обуславливает существенно более низкие показатели летальности. АВМ небольших размеров, имеющие более высокие показатели артериального давления в афференных артериях имеют большую склонность к геморрагическим проявлениям, чем крупные.
Морфологическими факторами риска геморрагического синдрома являются: глубокий венозный дренаж; кровоснабжение перфорирующими артериями; аневризмы внутри клубка АВМ; множественные аневризмы; АВМ вертебро-базилярного бассейна и подкорковых узлов. Частота повторных кровотечений из АВМ подкорковых узлов составляет 40%, из АВМ мозгового плаща - 33%. Дренирование в систему глубоких вен мозга также является фактором риска повторных кровоизлияний 34% против 3% при поверхностном оттоке.
Многими исследователями подчеркивается прямая взаимосвязь между размерами мальформации и риском кровотечения. По данным Itoyama Y. (1989) при размере АВМ менее 3 см в диаметре кровоизлияния развились в 87% наблюдений; от 3 до 6 см - в 73%, более 6 см - в 31%.
Клинические проявления АВМ укладываются в два варианта течения заболевания: геморрагический и торпидный. Первый вариант связан с развитием внутричерепных кровоизлияний на любом этапе течения болезни, второй – с неврологическими синдромами, характерными для объемного поражения мозга (эпилептическими припадками, головной болью и прогрессирующим неврологическим дефицитом). Распределение больных по первичному проявления заболевания близко к 1:1.
В настоящее время, принято классифицировать АВМ по анатомо-топографическим признакам, объему и степени «критичности» из расчета возможного хирургического удаления.
Вероятно, первую анатомо-топографическую характеристику АВМ дал H.Cushing (1928). Он выделял:
АВМ супратенториального пространства (89%)
Мозгового плаща (58%)
лобной, теменной, височной, затылочной долей
Глубинных структур и средней линии мозга (31%)
мозолистого тела, подкорковых ганглиев, желудочков мозга, зрительного бугра, гиппокампа.
АВМ субтенториального пространства (11%)
ствола мозга, мозжечка.
Подразделение АВМ по размерам является одним из определяющих факторов, влияющих на выбор лечебной тактики. Ю.М.Филатов (1972) выделяет:
Микромальформации (объемом менее 2см3);
Малые АВМ (менее 5см3);
АВМ среднего объема (от 5 до 20 см3);
Крупные АВМ (более 20 см3);
Гигантские АВМ (более 100 см3).
Для определения операбельности мальформации нередко решающее значение имеет фактор локализации АВМ, её связи с функционально значимыми зонами мозга. Классификации, создаваемые в последние годы, так или иначе учитывают основные факторы, влияющие на возможность безопасного удаления мальформации, в связи с чем учитывают как анатомические, так и функциональные характеристики мальформаций. Наиболее распространена и общепризнанна система градационного деления мальформаций по степени хирургического риска, предложенная R.Spetzler и N.Martin (1986).
| Баллы | |
| Подразделение АВМ по размерам | |
| < 3 см | |
| 3 - 6 см | |
| > 6 см | |
| Подразделение АВМ по локализации | |
| вне функционально значимой зоны | |
| в пределах функционально значимой зоны | |
| Подразделение АВМ по характеру дренирования | |
| не имеет «глубоких» дренирующих вен | |
| имеет «глубокие» дренирующие вены |
Таким образом, каждая мальформация наделяется определенным количеством баллов, сумма которых указывает ее градационную степень от I до V. Приведенная шкала обладает наилучшими прогностическими возможностями в отношении риска хирургического удаления мальформации. Потенциально операбельны мальформации I-III типа, при АВМ IV-V типов – показано комплексное этапное лечение.
Основные цели диагностики АВМ головного мозга могут быть сформулированы следующим образом:
· подтверждение наличия мальформации как причины внутричерепного кровоизлияния или эпилептического/псевдотуморозного синдрома (нозологическая диагностика);
· определение локализации, размеров, источников кровоснабжения и путей дренирования мальформации (анатомическая диагностика);
· оценка функциональной значимости артериовенозного шунтирования и функционального состояния мозгового кровообращения (функциональная диагностика);
· выявление субарахноидального кровоизлияния и внутричерепных гематом, их характера, распространенности, выраженности гипертензионного, гидроцефального, дислокационного синдромов;
· оценка неврологического и соматического статуса больного.
Основными задачами инструментальной диагностики мальформаций являются:
¨ постановка нозологического диагноза;
¨ идентификация питающих артерий и дренирующих вен;
¨ оценка ангиоархитектоники мальформации;
¨ выявление признаков ангиопатии «большого потока»;
¨ выявление изменений окружающего мозгового вещества;
¨ исключение сопутствующих поражений сосудов (аневризм).
Основными методами инструментальной диагностики АВМ в настоящее время являются:
I. Неинвазивные:
· ультразвуковая транскраниальная допплерография (ТКДГ);
· компьютерная томография (КТ) и спиральная компьютерная томоангиография (СКТА);
· магнитно-резонансная томография (МРТ) и магнитно-резонансная ангиография (МРА);
II. Инвазивные
· церебральная ангиография.
Организация специализированной нейрохирургической помощи больным с АВМ строится на ряде базисных положений:
1. Артериовенозные мальформации представляют собой одну из наиболее сложных и трудоемких для полноценной диагностики нозологических форм.
2. Полноценное лечение больных АВМ требует возможности проведения трех основных вариантов терапии: хирургического лечения, эмболизации, радиохирургического лечения.
3. Решение о лечебной тактике и хирургическое вмешательство на АВМ должно осуществляться хирургом, имеющим личный опыт в этой области.
4. Значительный вклад в благоприятный исход лечебных мероприятий оказывает высококвалифицированное анестезиологическое сопровождение.
При обсуждении вопроса о показаниях к активным методам лечения больных с АВМ исходят из соотношения риска спонтанного течения заболевания и риска осложнений того или иного способа терапии.
Риск спонтанного течения заболевания в настоящее время достаточно хорошо изучен. Он заключается в ежегодном 3% риске кровоизлияний из АВМ. В течение жизни глубокая инвалидизация наступает у 48% носителей АВМ, а еще 23% больных погибают. С учетом отсутствия достоверных различий исходов между АВМ с геморрагическим или торпидным течением все пациенты с диагностированными мальформациями должны рассматриваться в качестве кандидатов для хирургического лечения.
Основной задачей любого вида вмешательства является полная облитерация мальформации в целях профилактики первичных/повторных внутричерепных кровоизлияний.
Выбор лечебной тактики строится на представлениях о возможной степени радикальности того или иного способа воздействия:
* хирургическое лечение: технически осуществима радикальная экстирпация АВМ объемом до 100 см3;
* эмболизация: радикальное выключение АВМ из кровотока возможно у 10-40% больных, в остальных случаях - облитерация 15-75% объема мальформации;
* радиохирургическое лечение: возможна полная облитерация мальформаций диаметром менее 3 см у 85% больных (на протяжении 2 лет).
Исходя из этого, наиболее полноценным способом лечения остается прямое нейрохирургическое вмешательство, но в качестве самостоятельного метода оно применимо только у пациентов с низким риском послеоперационных осложнений. В целях снижения риска операции целесообразно использование предоперационной эмболизации для улучшения показателей гемодинамики за счет частичного выключения мальформации; облитерации труднодоступных питающих артерий; выключения «критических» компартментов АВМ.
Принципиальным показанием к применению эмболизации являются: неоперабельные мальформации с геморрагическим течением; неоперабельные мальформации с клиникой неконтролируемых эпилептических припадков, прогрессирующего дефицита, головных болей; мальформации, облучение которых возможно только после уменьшения объема.
Радиохирургическое лечение показано при: мальформациях малого объема (менее 3 см в диаметре), локализующихся в труднодоступных областях; остаточных АВМ после хирургического или внутрисосудистого лечения.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 549; Нарушение авторских прав?; Мы поможем в написании вашей работы!