
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понижение температуры замерзания разбавленного раствора пропорционально моляльной концентрации растворенного вещества
|
|
|
|
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объем раствора.
2. Давление насыщенного пара растворителя.
Важной характеристикой веществ, находящихся в жидком или твердом состоянии, является давление насыщенного пара. Давление насыщенного пара определяет при данной температуре равновесие между жидким (твердым) и газообразным состоянием вещества, которое устанавливается на границе раздела фаз. В любом растворе концентрация молекул растворителя в поверхностном слое меньше, чем в чистом растворителе, и равновесие может быть достигнуто при меньшем давлении насыщенного пара.
Под давлением насыщенного пара вещества понимают давление его паров в отсутствие других газов, в частности воздуха.
Первый закон Рауля:
Для разбавленных растворов относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе.
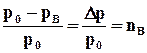
где р0 – давление насыщенного пара растворителя над чистым растворителем;
р - давление насыщенного пара растворителя над раствором;
nв – мольная доля растворенного вещества.
Следующая закономерность, характеризующая поведение растворов, относится к изменению температур кристаллизации и кипения при переходе от чистого растворителя к раствору.
3. Понижение температуры замерзания раствора (криоскопия).
При понижении температуры давление пара над раствором снижается, и когда оно становится равным давлению пара соответствующей твердой фазы, жидкость замерзает. Давление пара над раствором ниже давления пара над чистым растворителем, поэтому раствор будет замерзать при более низкой температуре, т.е. температура кристаллизации раствора всегда ниже температуры кристаллизации чистого растворителя.
Тзамерз – температура, при которой Рн.п. над жидкостью становится равным Рн.п. над кристаллами этой жидкости (при Тзам начинают выделяться первые кристаллы).
ΔТзам = Тз/ - Тз
ΔТзам - понижение температуры замерзания
Тзам измеряется с помощью специальных метастатических ртутных термометров (термометров Бекмана) с ценой деления 0.01 К. Такие термометры имеют шкалу только на 5 К, но снабжены дополнительным резервуаром для ртути, позволяющим настроить его на любые абсолютные температуры от 260 до 380 К.
Второй закон Рауля:
ΔТзамерз = К∙b,
ΔТзамерз = i·К·m, (для р-ров электролитов)
где b – моляльность;
К - криоскопическая константа, зависящая только от природы растворителя и не зависящая от природы растворенного вещества. Для воды К=1.86, для бензола К=5,07.
4. Повышение температуры кипения раствора (эбуллиоскопия). Помимо криоскопического метода в химии применяется эбуллиоскопический метод, основанный на измерении температуры кипения растворов.
При повышении температуры давление пара над раствором растет, и когда оно достигает внешнего давления, наблюдается кипение раствора. Давление пара над раствором ниже давления пара над чистым растворителем, поэтому равенство давления пара и внешнего давления будет достигнуто при более высокой температуре, т.е. температура кипения раствора всегда выше, чем тепмпература кипения чистого растворителя.
Второй закон Рауля:
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!