
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Третичная структура белков
|
|
|
|
Изгиб
В области неупорядоченных структур достаточно протяжённые зоны представлены петлями и резкими изгибами.
Наиболее часто встречаются так называемые β-изгибы, когда полипептидная цепь резко меняет своё направление на 180º. Этот изгиб по форме напоминает шпильку для воло с и образуется между тремя аминокислотами за счет водородной связи (см. презентацию к лекции). Он необходим для изменения пространственного расположения полипептидной цепи при образовании третичной структуры белка.
!!! Какую именно конформацию принимают участки полипептидной цепи (α-спираль, β‑складку, β-изгиб или остаются неструктурированными) в значительной степени определяется первичной последовательностью полипептидной цепи.
Третичная структура белков – это трёхмерная структура полипептидной цепи, которая определяется первичной и вторичной структурой и характеризуется наличием биологической активности.
Это объясняется тем, что в результате взаимодействий аминокислотных остатков полипептидной цепи уменьшается свободное вращение связей полипептидного остова.
Ограничение подвижности и тем самым формирование и поддержание третичной структуры возникает также за счёт общего вклада слабых нековалентных взаимодействий (Рис. 2.9):
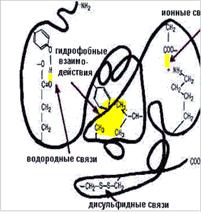
Рис. 2.9. Связи, стабилизирующие третичную структуру белковой молекулы:
1 - электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи); 2 - водородные связи между полярными (гидрофильными) R-группами; 3 - гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
4 - дисульфидные связи между радикалами двух молекул цистеина.
Рассмотрим особенности строения третичной структуры белковой молекулы на примере одного из самых простых белков – инсулина. Первичная последовательность инсулина приведена на рисунке 2.10, а третичная структура - на рисунке 2.11:

Рис. 2.10. Первичная последовательность гормона инсулина. Показаны
S–S-мостики и участки первичной последовательности, образующие вторичные структуры
Гормон состоит из двух пептидных цепей — короткой (21 аминокислотный остаток) и длинной (30 аминокислотных остатка).
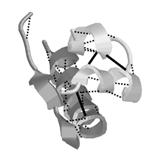
Рис. 2.10. Третичная структура инсулина. Здесь спиралями представлены
a -спиральные участки, стрелками - b -складки и цилиндрическими кривыми - нерегулярные участки. Пунктиром показаны водородные связи, а сплошными линиями - S–S‑мостики.
На рисунке хорошо видно, что три S–S-мостика играют ключевую роль в организации третичной структуры:
- один из них взаимно ориентирует две α-спирали короткой последовательности;
- два других скрепляют короткую и длинную цепи;
- третичная последовательность буквально пронизана водородными связями;
- третичная структура инсулина состоит в основном из α-спиралей.
Третичная структура белковой молекулы возникает самопроизвольно. Движущей силой, свёртывающей полипетидную цепь белка в строгое трёхмерное образование, является взаимодействие аминокислотных радикалов с молекулами воды.
При этом гидрофобные радикалы втягиваются внутрь белковой молекулы, образуя там гидрофобную зону (гидрофобный карман), а гидрофильные радикалы ориентируются в сторону растворителя – воды.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 567; Нарушение авторских прав?; Мы поможем в написании вашей работы!