
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионизация молекул образца
|
|
|
|
7.4.1.Метод электронного удара.
 |
Это наиболее распространенный метод, основанный на ионизации вещества налетающими электронами, разогнанными в электронном пучке до определенной энергии. Налетающий, возбуждающий электрон, выбивает из молекулы электрон, превращая ее в катион-радикал:
Энергетический баланс:
ε0 = ε1 + Δε (7.2)
где ε0 – энергия возбуждающего электрона,
ε1 – энергия рассеянного электрона,
Δε – потеря энергии:
Δε = ПИ + ε2 + ε+ (7.3)
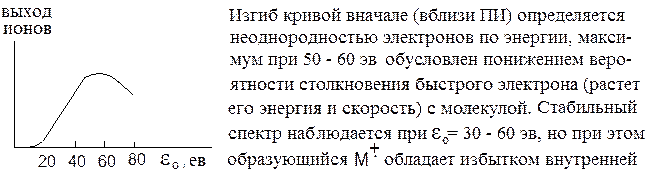
где ПИ – потенциал ионизации т.е. энергия, необходимая для удаления электрона с занимаемой им орбитали на бесконечно большое расстояние от молекулы. Минимальная энергия, которую должен иметь электрон, чтобы вызвать ионизацию должна быть Δεmin = ПИ. Для большинства органических соединений ПИ = 7-13 эв. Интенсивность ионного пучка (выход ионов) зависит от ε:
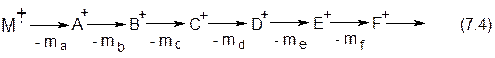 |
энергии, что приводит к его неустойчивости и распаду на дочерние (фрагментарные или осколочные) ионы:
Схема устройства ионизационной камеры при электронном ударе предсталена на следующем рисунке:
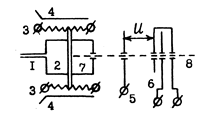 1 – система напуска (капилляр с молекулярной диа-
1 – система напуска (капилляр с молекулярной диа-
фрагмой; 2 – ионизационная камера; 3 – катод и
анод; 4 – фокусирующий магнит; 5 – вытягивающий
электрод; 6 – ускоряющий электрод и система линз;
фокусирующих ионы в пучок; 7 – электронный пу-
чек; 8 – пучок ионов; u – ускоряющий потенциал.
Недостаток метода – образуется много фрагментарных ионов, вследствие чего при росте молекулярной массы интенсивность пучка молекулярных ионов существенно снижается, а для некоторых классов соединений, например, третичных спиртов и особенно природных высокомолекулярных соединений пик М+× совсем исчезает.
Принципиально возможен также процесс захвата электрона молекулой с образованием анион-радикала:
 М + е М-× (7.5)
М + е М-× (7.5)
Поскольку при одинаковых условиях количество образовавшихся анионов на 2-3 порядка меньше катионов, в настоящее время масс-спектрометрия отрицательных ионов как метод исследования органических соединений практически не развита в отличие от метода, использующего положительнве ионы.
7.4.2.Метод фотоионизации.
Молекулы ионизируют интенсивным коротковолновым излучением, например, гелиевые разрядные лампы дают излучение eо = 21,21 эв. Им можно ионизировать практически все органические молекулы. Использование источников с непрерывными спектрами и монохроматоров позволяет плавно изменять длину волны фотонов, вследствие чего фотоионизация успешно применяется для определения ПИ с точностью до 0,05 – 0,01 эв. Масс-спектр при фотоионизации имеет те же особенности, что и при электронном ударе: много фрагментарных и мало молекулярных ионов. Поэтому и этот метод мало пригоден для изучения природных соединений
7.4.3.Метод ионизации на нагретой поверхности.
Пары вещества направляются на разогретую до высокой температуры поверхность. Этот метод также малопригоден для изучения природных соединений и продуктов метаболизма.
7.4.4.Метод химической ионизации.
Ионизация происходит при столкновении исследуемых молекул с пучком ионов, образованных методом электронного удара из газа-реагента (или газа-носителя) при давлении ~ 1 мм рт. ст. В качестве газа-реагента используют различные вещества, которые при этом давлении существуют в виде газа. Этот метод ионизации очень удачен в случае хромато-масс-спектрометрии, где роль реагента играет газ-носитель (особенно Не или Н2). При действии электронного удара из газов-реагентов образуются следующие ионизирующие ионы и продукты химической ионизации:
| Газ-реагент | Ионизирую-щий ион | Продукт ионизации | Ионизация |
      Не
Н2
Н2О
СН4
(СН3)3СН
NH3
(CH3)4Si Не
Н2
Н2О
СН4
(СН3)3СН
NH3
(CH3)4Si
| Не+ Н3+ Н3О+ CH5+,C2H5+ С4Н9+ NH4+,(NH3)2H+ (CH3)3Si+ | М+- молекулярн. ион МН+ квази- МН+, МН3О+ моле- МН+ ку- МН+ лярные МН+,NH4M+ ионы (CH3)3SiM+ | Не+ + М Не + М+ Н3+ + М Н2 + МН+ СН4 + е СН4+× +2е СН4 +СН4+ × СН5+ + СН3× СН5+ + М МН + СН4 |
Молекулы вещества вводятся в количестве ≈ 0,6% от количества ионизирующего газа, что практически исключает ионизацию электронным ударом, а также столкновению ионов между собой.
В случае применения Не (Ne, N2, CO), образуются сильно возбужденные М+, вследствие чего спектр мало отличается от спектра методом электронного удара, а метод малопригоден для анализа природных соединений.
В случае метана, изобутана, Н2 образуется квазимолекулярный ион МН+. В случае ТМС и аминов образуется квазимолекулярный ион как продукт присоединения М к ионизирующему газу. Квазимолекулярные ионы обладают малой внутренней энергией, вследствие чего дают мало фрагментов, и в спектре всегда наблюдаются пики квазимолекулярных ионов, причем интенсивные. Поэтому применение этих газов-реагентов очень эффективно при изучении веществ в живых организмах.
Интересной особенностью химической ионизации является избирательное взаимодействие некоторых газов-реагентов с определенными классами реагентов, что открывает большие возможности, как при анализе смесей природных соединений, так и для установления строения отдельных продуктов метаболизма.
7.4.5. Полевая ионизация.
Ионизация осуществляется при движении молекулы М в электрическом поле высокого напряжения с градиентом потенциала dV/dx ~ 10+7 в/см на расстояния - 0,1 нм от анода. В качестве анода используется точечный электрод (острие или тонкая проволока). Чем выше кривизна поверхности, тем выше градиент потенциала. Ионизация осуществляется путем туннельного квантового перехода электрона с молекулы на анод. Внутренняя энергия образующегося при этом М+× намного меньше, чем при ионизации электронным ударом, вследствие чего этим методом удается наблюдать интенсивные пики молекулярных ионов, отсутствующие в спектрах электронного удара.
7.4.6. Десорбция сильным электрическим полем.
Модификация метода полевой ионизации: для термически нестабильных соединений применяется метод десорбции сильным электрическим полем. Вещество наносится на анод путем погружения последнего в раствор вещества. Молекулы твердого вещества, адсорбированные на сильно развитой поверхности анода, ионизируются сильным электрическим полем с последующей десорбцией образовавшихся ионов. Здесь отпадает необходимость в нагреве образца для его испарения. Все это очень важно для анализа продуктов метаболизма.
Современные масс-спектрометры оборудованы комбинированными источниками ионов, дающими возможность применять все методы ионизации в зависимости от поставленной задачи.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 954; Нарушение авторских прав?; Мы поможем в написании вашей работы!