
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория МО ЛКАО. Связывающие и разрыхляющие орбитали
|
|
|
|
Предисловие. Сущность метода.
Этот тип электронной спектрометрии базируется на поглощении веществом УФ и видимого излучения, что приводит к изменению состояния валентных электронов молекул или атомов, но при этом электроны молекулу не покидают. Они только с занятой электронной орбитали переходят на более высокую по энергии свободную орбиталь. Электронная спектрометрия поглощения отличается от еще одного вида электронной спектрометрии, а именно от фотоэлектронной спектрометрии (ФЭС) тем, что в ее случае вещество не ионизируется, тогда как в случае ФЭС электроны выбиваются из молекулы и вещество ионизируеися.
Чтобы понять сущность электронной спектрометрии поглощения, как и ФЭС, надо знать состояние электронных орбиталей, связанное со строением вещества. Именно этими проблемами и занимается квантовая механика, Поэтому повторим некоторые вопросы теории строения.
13.2.1. Образование s-связей.
Рассмотрим образование s-связи на примере молекулы водорода:
 Н· + Н· Н2
Н· + Н· Н2
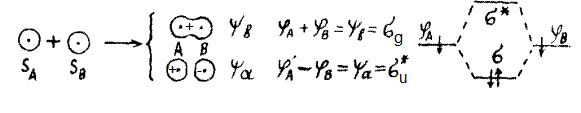
Здесь sA и sB – s-орбитали атомов водорода, yb и ya – волновые функции (пси) связывающей и разрыхляющей молекулярных орбиталей водорода, j (фи) – одноэлектронная волновая функция атомной орбитали, sg и s*u – соответственно связывающая симметричная (относительно цента симметрии) и разрыхляющая антисвязывающая s-орбитали молекулы водорода. Энергия одноэлектронных орбиталей Еj при их взаимодействии расщепляется на энергии молекулярных орбиталей Еy в соответствии с уравнением:
Eψ=(Eφ ± β)/(1 ± S),
где β – резонансный интеграл, S – интеграл перекрывания.
Подобная картина имеет место и при образовании s-орбиталей из гибридных sp, sp2 и sp3 атомных орбиталей атомов углерода.
14.2.2. Образование p-связей.
Рассмотрим образование p-связей на примере молекулы этилена из sp2 гибридных орбиталей атома углерода и молекулы формальдегида из sp2 гибридной орбитали углерода и из sp гибридной орбитали атома кислорода:
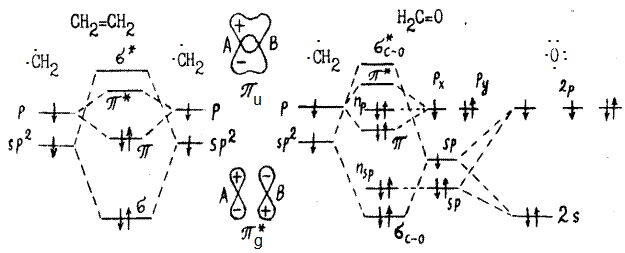
Симметрия p-орбиталей относительно цетра симметрии (центра тяжести) противоположна той, которая имеет место для s-орбиталей. Расщепление энергии при образовании p-орбиталей за счет бокового перекрывания р-орбиталей существенно меньше, чем при образовании s-орбиталей за счет осевого перекрывания s-орбиталей и гибридных орбитаей с любой долей s-орбиталей.
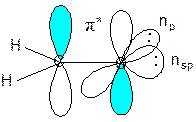 |
В формальдегиде на атоме кислорода гибридизуются толко те орбитали, которые лежат на связи С-О, т.е здесь имеет место sp-гибридизация. Кроме того, в этой молекуле появляется еще один тип орбиталей – несвязывающие n-орбитали, на которых находятся свободные электронные пары:
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1447; Нарушение авторских прав?; Мы поможем в написании вашей работы!