
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аминокислоты, первичная структура белка
Аминокислоты являются бифункциональными соединениями, которые содержат в молекуле две реакционноспособные группы: карбоксильную (–СООН) и аминогруппу (–NH2), и так называемую R- группу (боковую цепь, радикал). Аминокислоты (кроме глицина) являются оптически активными соединениями, и соответственно, существуют в двух стереоизомерных формах (L и D – формы), вращающих плоскость поляризации света, соответственно, влево и вправо. Живые клетки синтезируют и усваивают только L-аминокислоты, а D- изомеры аминокислот не способны транспортироваться через биомембраны. Однако, L- или D-стереоизомеры за длительный срок самопроизвольно и неферментативно претерпевают взаимные превращения и в конечном счете устанавливается эквимолярная смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов находится белок дентин, в котором L-аспарагиновая кислота переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по относительному содержанию D- или L- аспартата можно рассчитать возраст обследуемого.
В естественных белках встречаются преимущественно α-аминокислоты, в молекуле которых аминогруппа присоединена к первому атому (α-атому) углерода; у b-аминокислот аминогруппа находится при втором атоме углерода. Общая структурная формула  -аминокислот приведена на рисунке 1. Молекула аминокислоты содержит и кислотную (СООН), и основную (NH2 ) группы, которые могут находится в заряженном состоянии (СОО- и NH3+). Соответственно, аминокислоты, в зависимости от рН среды, могут находиться в молекулярной или в ионизированной форме биполярного иона, (цвиттериона). В физиологических условиях равновесие в этой реакции сильно смещено в сторону цвиттериона.
-аминокислот приведена на рисунке 1. Молекула аминокислоты содержит и кислотную (СООН), и основную (NH2 ) группы, которые могут находится в заряженном состоянии (СОО- и NH3+). Соответственно, аминокислоты, в зависимости от рН среды, могут находиться в молекулярной или в ионизированной форме биполярного иона, (цвиттериона). В физиологических условиях равновесие в этой реакции сильно смещено в сторону цвиттериона.
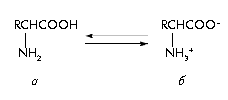
Рис. 1. Молекулярная (а) и цвиттерионная (б) формы аминокислот
В таблице приведены названия, структурные формулы, а также стандартные трех- и однобуквенные обозначения 20 важнейших аминокислот, входящих в состав белков.
Таблица 1. Названия, обозначения и структурная формула  -аминокислот, входящих в состав природных полипептидов
-аминокислот, входящих в состав природных полипептидов

Аминокислоты в таблице можно было бы расположить разными способами, например в алфавитном порядке или в порядке возрастания молекулярных масс. Однако наиболее удобной классификацией является подразделение аминокислот на четыре группы согласно полярности их боковых цепей: неполярные; полярные, но не образующие ионов; кислотные; основные.
Непосредственно в синтезе белков живых организмов принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты - производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина - 5-гидроксилизин и 4-гидроксипролин.
Модификации аминокислотных остатков осуществляются уже в составе белков, т.е. только после окончания их синтеза (пострансляционная модификация). Введение дополнительных функциональных групп в структуру аминокислот придаёт белкам свойства
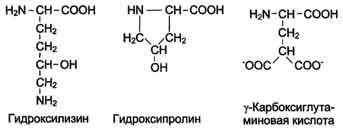
Рис. 2. Модифицированные аминокислоты, найденные в составе белков
необходимые для выполнения ими специфических функций. Так, γ-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
|
Дата добавления: 2014-01-20; Просмотров: 1854; Нарушение авторских прав?; Мы поможем в написании вашей работы!