
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элемент Даниэля
|
|
|
|
Устройство электрохимической ячейки. Терминология.
H2O2 + 2KMnO4 ® 3O2 + 2MnO2 + 2H2O + 2KOH
PbS + 4H2O2 ® PbSO4 + 4H2O
Восстановительные свойства H2O2
H2O2 + KMnO4 ® MnO2 + O2 + …
3÷ H2O2 + 2OH¯ - 2e ® 2H2O + O2 окисление
2÷ MnO4¯ + 2H2O + 3e ® MnO2 + 4OH¯ восстановление
3H2O2 + 2MnO4¯ ® 3O2 + 2MnO2 + 2H2O + 2OH¯
Самоокисление-самовосстановление H2O2
1÷ H2O2 – 2e ® 2H+ + O2 или 1÷ H2O2 +2OH¯– 2e ® 2H2O + O2
1÷ H2O2 + 2H+ + 2e ® 2H2O 1÷ H2O2 + 2e ® 2OH¯
2H2O2 ® 2H2O + O2
Одна из ключевых задач химии – предсказание направления и глубины протекания химической реакции.
Характерная особенность ОВР, отличающая этот вид химических реакций от других, состоит в том, что процессы окисления и восстановления можно пространственно разделить, если проводить реакцию в электрохимической цепи. При этом удаётся осуществить перенос электронов через металлический проводник и измерить величину, непосредственно связанную с, - электродвижущую силу (ЭДС).
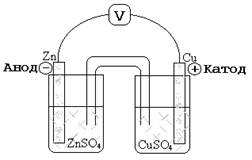
Рассмотрим устройство и работу электрохимической цепи на примере элемента Даниэля (рис.1). Он состоит из цинкового электрода, погруженного в раствор сульфата цинка, и медного электрода, погруженного в раствор сульфата меди. Электроды соединены металлическим проводником, а растворы – солевым мостиком. Солевой мостик – это трубка, заполненная раствором какого-либо электролита (например, КCl). Один конец трубки погружён в раствор ZnSO4, другой – CuSO4 (рис.1). При погружении металлического проводника в раствор, содержащий катионы того же самого металла устанавливается динамическое равновесие между катионами М 2+, находящимися в растворе, и атомами М на поверхности электрода:
М 2+ + 2e = М.
Часть атомов М в виде катионов M 2+ переходит в раствор, в тоже время катионы М 2+ могут восстанавливаться на поверхности электрода. Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно. Если электроды изолированы, то данные процессы быстро остановятся. Поэтому для того, чтобы в электрохимической цепи протекала окислительно-восстановительная реакция, необходимо, чтобы электроды были соединены проводником, а растворы - солевым мостиком. В этом случае электроны перемещаются от электрода с меньшим потенциалом (Zn) к электроду с большим потенциалом (Cu).
CuSO4 + Zn ® Cu + ZnSO4
Рис.1. Схема устройства элемента Даниэля.
| Электрод, на котором протекает процесс окисления, называется анодом Zn 0 –2e = Zn2 +. Электрод, на котором протекает процесс восстановления, называется катодом Сu2 + + 2e = Cu 0. |
Если ОВР в электрохимической цепи протекает самопроизвольно, то она называется гальваническим элементом. Гальванические элементы находят применение в качестве химических источников тока. Если ОВР идёт под внешним воздействием в направлении противоположном самопроизвольному, то такая электрохимическая цепь называется электролитической ячейкой. В ней протекает электролиз. Действительно, если к элементу Даниэля подключить внешний источник тока и подать на Сu - и Zn- электроды достаточно большие положительный и отрицательный потенциалы, соответственно, то на электродах будут протекать процессы, противоположные самопроизвольным:
Cu 0 – 2e = Cu 2+ (анод, окисление)
Zn2+ +2e = Zn0 (катод, восстановление)
Cu 0 + Zn2+ = Cu 2+ + Zn0
| ЭЛЕКТРОХИМИЧЕСКАЯ ЦЕПЬ |  
| ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ (ОВР протекает самопроизвольно) сокращенная форма записи: y Zn ï ZnSO4 (C1)ú÷ KCl ú÷ CuSO4 (C2)ï Cu Å |
| ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА (ОВР идет в направлении, обратном самопроизвольному) сокращенная форма записи: Å Cu ï CuSO4 (C1)ú÷ KCl ú÷ ZnSO4 (C2)ï Zn y |
Стандартный элеткродный потенциал металла (Eо) – это ЭДС гальванического элемента при условии, что один полуэлемент – водородный (C(H+)= 1M, р(Н2)=1 атм, Т = 298 К), а второй – металл, погруженный в раствор его соли с концентрацией ионов металла 1М. Металлы расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый ряд стандартных элеткродных потенциалов.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 548; Нарушение авторских прав?; Мы поможем в написании вашей работы!