
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 9. На этой стадии реакции молекула этилена играет роль основания, а ион водорода – кислоты
|
|
|
|
А В
В А
На этой стадии реакции молекула этилена играет роль основания, а ион водорода – кислоты. В образовавшейся частице (карбокатионе) атом углерода имеет свободную орбиталь и становится кислотой.
На второй стадии реакции к атому углерода в карбокатионе присоединяется анион хлора, имеющий 4 неподеленные электронные пары. Карбокатион играет роль кислоты, а ион хлора – основания. Для изображения схемы взаимодействия достаточно обозначить одну электронную пару хлора:
|
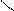 Н
Н

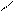 С – СН3 +:Cl– ® СН2Cl – СН3
С – СН3 +:Cl– ® СН2Cl – СН3
 Н
Н
Из показанного схематически процесса присоединения хлороводорода к этилену видно, что на первой стадии органическая молекула реагирует как основание, а на второй стадии образовавшийся карбокатион – как кислота.
Вообще, теория механизмов органических реакций базируется на электронной теории кислот и оснований.
Электронная теория Льюиса широко применяется в химии комплексных соединений, так как связи между центральным атомом и лигандами образуются по донорно-акепторному мехенизму. Центральный атом со свободными орбиталями это кислота, лиганды с неподеленными электронными парами – основания. Здесь, однако, обнаруживается слабая сторона теории Льюиса. Это невозможность построения единой шкалы для силы льюисовских кислот и оснований. Это можно показать на примере устойчивости комплексных соединений. Комплекс бериллия с ионами фтора [BeF4]2– более устойчив, чем комплекс меди [CuF4]2–. Это можно считать признаком более сильных кислотных свойств иона Be2+ по сравнению с ионом Cu2+. Но если сравнить устойчивость аммиачных комплексов, то оказывается, что [Cu(NH3)4]2+ более устойчив, чем [Be(NH3)4]2+. Очевидно, что сила кислот изменяется в различной последовательности по отношению к разным основаниям. Иначе можно сказать, что наблюдается избирательность взаимодействия кислот с разными основаниями.
Следует отметить, что представления о кислотах и основаниях в теории сольвосистем согласуются с представлениями электронной теории. Выше рассмотрен пример оксида SO3, показывающий, что он ведет себя как кислота. Выясним, является ли он кислотой согласно теории Льюиса. Представим схематически механизм реакции с водой:
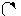 |
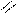
 O H O O–
O H O O–
 O = S: O → S + H+
O = S: O → S + H+
 O H O OH
O H O OH
Атом серы в оксиде проявляет себя как кислота, будучи акцептором электронной пары кислорода, находящегося в молекуле воды. При этом электроны π-связи смещаются от серы к кислороду. Один из протонов воды остается в виде иона.
На электронной теории кислот и оснований основана концепция жестких и мягких кислот и оснований (ЖМКО), предложенная в 60-х годах прошлого века Р. Пирсоном. Концепция ЖМКО позволяет прогнозировать избирательное взаимодействие льюисовских кислот и оснований.
Жесткие кислоты и основания – это частицы, точнее соответствующий центр (атом) в частицах – имеющие малый радиус, трудно поляризующиеся.
Мягкие кислоты и основания – это частицы, имеющие кислотный или основной центр (атом) большого радиуса, легко поляризующийся.
| жесткие | мягкие | |
| Кислоты А | H+ (предельно жесткая), Na+, Ca2+, Mg2+, Al3+, H2O, Fe3+, | Ag+, Cu+, Tl+, Cd2+, Hg2+ |
| Основания В | F–, OH–, O2–, H2O, Cl– | I–, S2–, R–S–, As3– |
В группах сверху вниз наблюдается переход от жестких к мягким частицам (галогены).
Так в чем же значение этой классификации кислот и оснований?
Жесткие кислоты преимущественно образуют связи с жесткими основаниями, а мягкие кислоты – с мягкими основаниями.
В этом состоит предсказательное значение концепции ЖМКО.
Мягкие частицы образуют между собой преимущественно ковалентные связи, а жесткие – ионные.
Самопроизвольные кислотно-основные реакции идут не только в направлении от сильных к слабым, но и от частиц, сочетающих жесткий центр с мягким, к частицам, сочетающим мягкий центр с мягким и жесткий центр с жестким.
В организме человека жесткие кислоты Na+, K+, Mg2+, Ca2+,H+. Жесткие основания ОН –, F –
Мягкие кислоты – ионы d -элементов (медь, железо и др.). Железо(II) мягче железа(III). Мягкие основания – HS–, RS–, RSR. Токсичность ионов тяжелых металлов (таллий, ртуть, свинец) обусловлена их способностью образовывать связи с серой белков. Это ведет к блокированию ферментативной активности.
Явление симбиоза. Мягкий лиганд смягчает жесткую частицу:
KA–Zn2+ – связи с ионами галогенов ослабевают в ряду I – > Br – > Cl – > F – (КА – карбоангидраза)
H2O–Zn2+ – связи с ионами галогенов ослабевают в ряду F – > Cl – > Br – > I –
Важна не только характеристика частицы как таковой, но и ее положение относительно воды как растворителя, в котором обычно и осуществляются интересующие нас превращения. Например, среди галогенов фтор отделен от хлора в ряду понижения жесткости располагающейся между ними водой (также и ОН–):
F– > H2O (OH–) > Cl– > Br– > I–
Отсюда возникают любопытные закономерности в растворимости:
Ag+ < H2O < Li+ Li+×nH2O + F– = LiF¯ + nH2O
I– < H2O < F– Ag+×nH2O + I– = AgI¯ + nH2O
AgF + LiI = AgI¯ + LiF¯
Растворимость AgF >> AgCl > AgBr > AgI
170 г 0,002 г
Растворимость LiF << LiCl < LiBr < LiI
0,26 г 78,5 177 165
Дополнительное.
Радиус атома Н 50 пм (10–10 м). Радиус иона Н+» 0,01 пм (10–14 м).
Радиус атома Li 155 пм (10–10 м). Радиус иона Li+ 68 пм.
| Жесткие кислоты | Мягкие кислоты | ||
| +3 +4 | Сr, Co, Fe, As, CH3SH Si, Ti, Zr, U, Sn | +1 +2 | Cu, Au, Tl, Hg2+ Pd, Cd, Pt, Hg, CH3Hg+, Co(CN)52–, Pt4+, Tl3+ |
| Жесткие основания | Мягкие основания | ||
| H2O, OH–, F–, NO3–, CH3COO–, PO43–, SO42–, Cl–, CO32–, NH3, RNH2 | R2S, RSH, RS–, I–, SCN–, S2O32–, R3P, CN–, R-NC, CO, C2H4, H–, R– |
Промежуточные основания: C2H5NH2, C5H5N, NO2–, SO32–, O2, Br–.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 491; Нарушение авторских прав?; Мы поможем в написании вашей работы!