
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Щелочность почв
|
|
|
|
Щёлочность почв – способность почв нейтрализовать компоненты кислой природы и подщелачивать воду. Различают актуальную и потенциальную формы шелочности.
Актуальная щелочность. Актуальная щелочность связана с наличием в почвенном растворе гидролитически щелочных солей, при диссоциации которых образуется гидроксильный нон:
Na2CO3 + 2HOH ↔ H2CO3 + 2 Na+ + 2OH-
Определенное значение в формировании щелочности почв имеют анионы слабых кислот. Практически все анионы слабых кислот, присутствующие в почвенном растворе, могут участвовать в формировании щёлочности почвы, образуя сопряженные кислотно-основные пары.
Реальный вклад того или иного соединения в щёлочность почвы определяется не только величиной константы основности, но и концентрацией ионов в почвенных растворах. Обычно при характеристике актуальной щёлочности природных вод, водных вытяжек и почвенных растворов выделяют общую щелочность, щёлочность от нормальных карбонатов и щелочность от гидрокарбонатов, которые отличаются по граничным значениям рН. Их определяют путем титрования вытяжки кислотой в присутствии различных индикаторов. Результаты выражают в мг-экв/100 г почвы. Щёлочность от нормальных карбонатов обусловлена присутствием Na2CO3, СаСО3, МgСОз. Щёлочность от гидрокарбонатов связана с NaНСО3 и Са(НСО3)2. В большинстве почв с щелочной реакцией преобладают карбонаты, которые и обусловливают соответствующую реакцию среды. В связи с этим выделяют карбонатно—кальциевую систему и карбонатно-кальциевое равновесие. Карбонатно-кальциевая система включает СаС03 твердой фазы, ионы в ППК, ноны почвенного раствора: Са2+, Са НСО3+, CO32- ОН-, Н+, Н2С03, а также СО2 почвенного раствора, находящегося в равновесии с СО2 почвенного воздуха. Эта система очень подвижная и включает несколько равновесий:
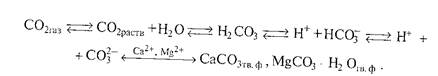
При уменьшении парциального давления СО2 равновесие сдвигается в сторону образования СО-групп. В этом случае образуется труднорастворимое соединение СаСО3, выпадающее в осадок, и увеличивается рН почвенного раствора, так как СО является более сильным акцептором протонов, чем НСО3-, и в большей степени подщелачивает среду. В итоге на фоне увеличения рН величина карбонатной щелочности снижается. Увеличение парциального давления СО2 приводит к уменьшению рН и росту карбонатной щелочности в результате увеличения раствори-
мости СаСО3.
Расчеты показывают, что рН раствора, находящегося в равновесии с СаС03 твердой фазы и СО2 атмосферы, имеет значение 8,2-8,3. Когда же свободный доступ СО2 затруднен, значения рН достигают 9,8-10,0.
Потенциальная щелочность обусловлена наличием в ППК обменно-поглощённого иона натрия, который при определенных условиях может переходить в почвенный раствор с образованием карбонатов и гидрокарбонатов, вызывая его подщелачивание. Например, при образовании угольной кислоты вследствие дыхания растений и разложения органических остатков происходит переход карбоната кальция в более растворимый гидрокарбонат с последующим ионном обменом:
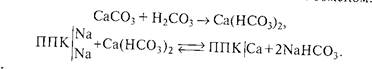
Угольная кислота может непосредственно взаимодействовать с поглощающим комплексом почв, содержащих обменный натрий, с образованием соды (карбоната натрия):
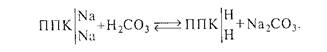
Почвы с щелочной реакцией среды формируются в регионах с дефицитом атмосферных осадков, где ограничен вынос из почв и почвообразующих пород продуктов выветривания и почвообразования. Щелочная реакция среды типична для каштановых и светло-каштановых, бурых полупустынных и серо-бурых пустынных почв, сероземов карбонатных разностей черноземов и темно-каштановых почв, особенно высокой щёлочностью отличаются содовые солонцы и солончаки.
Высокая щелочность почв неблагоприятна для большинства сельскохозяйственных культур. В условиях щелочной среды в растениях нарушается обмен веществ, снижается растворимость и доступность фосфатов, соединений железа, меди, марганца, бора и цинка. При щелочной реакции в почвенном растворе появляются токсичные для растений вещества, в частности сода и алюминаты натрия. В случае резкого повышения рН корневые волоски растений испытывают щелочной ожог, что негативно отражается на их дальнейшем развитии и может привести к отмиранию. сильнощелочные почвы характеризуются ярко выраженными отрицательными агрофизическими свойствами, что связано с сильной пептизацией почвенных коллоидов и растворением гумусовых веществ. Такие почвы оструктуриваются, приобретают высокую липкость во влажном состоянии и твердость в сухом, отличаются плохой фильтрацией и неудовлетворительным режимом. Сильнощелочные почвы малоплодородны.
Эффективный прием повышения плодородия почв с щелочной реакцией — химическая мелиорация. В качестве мелиоранта широко применяют гипс и различные вещества.
При внесении гипса в щелочные почвы происходит, с одной стороны, нейтрализация солью почвенного раствора, с другой — вытеснение обменного натрия из ППК:

После гипсования содовых почв, а также в натурных карбонатных почвах реакция среды будет находиться на уровне, определяемом наличием СаСОз и МgCОз (рН 8,2-8,6). При необходимости дальнейшего снижения рН применяют кислые мелиорирующие вещества, в частности серную кислоту. Кислование содовых почв высокоэффективный прием. При кисловании происходит не только полная нейтрализация щелочности, но и вытеснение натрия из ППК:

Важное условие эффективного проведения химической мелиорации щелочных почв - удаление продуктов нейтрализации и обменных реакций, чаще всего сернокислого натрия. Хотя сульфат натрия менее вреден для растений, чем, например, сода, его присутствие в почве все же нежелательно. Кроме того, возможно обратное поглощение натрия ППК почвы. Для удаления легкорастворимых солей натрия, образующихся при химической мелиорации, применяют промывки почв.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 7235; Нарушение авторских прав?; Мы поможем в написании вашей работы!