
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные спектры
|
|
|
|
Верхней энергетической границей колебательного спектра обычно считают энергию фотонов примерно в 5000 см -1 или около 60 кДж / моль. Дальнейшее увеличение энергии излучения (видимое и ультрафиолетовое) приводит к возбуждению электронов и появлению в спектре полос, соответствующих электронным переходам между различными энергетическими уровнями в молекуле.
Дискретные энергетические состояния молекулы можно охарактеризовать волновой функцией на основе квантово - механических представлений. При поглощении излучения молекула переходит из основного
на основе квантово - механических представлений. При поглощении излучения молекула переходит из основного 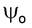 в возбужденное
в возбужденное состояние. Разность энергий двух уровней должна соответствовать условию:
состояние. Разность энергий двух уровней должна соответствовать условию:
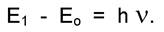
Значения волновых функций 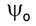 и
и в принципе можно
в принципе можно
рассчитать при помощи метода молекулярных орбиталей или валентных связей.
Электроны в молекуле могут занимать различные орбитали. Различают следующие молекулярные орбитали (МО):
 - связывающая,
- связывающая,
 - разрыхляющая, n - несвязывающая,
- разрыхляющая, n - несвязывающая,
 - связывающая,
- связывающая,
 - разрыхляющая.
- разрыхляющая.
 - связи встречаются преимущественно в молекулах с одинарными связями,
- связи встречаются преимущественно в молекулах с одинарными связями, - связи - в молекулах с двойными и тройными связями; примерами типичных веществ с n - орбиталями являются спирты, органические сульфиды и др., т. е. органические соединения с гетероатомами - N, O, S, галогенами.
- связи - в молекулах с двойными и тройными связями; примерами типичных веществ с n - орбиталями являются спирты, органические сульфиды и др., т. е. органические соединения с гетероатомами - N, O, S, галогенами.
Схема относительного расположения энергетических уровней, соответствующих разным МО, показана на рис.1.7.3.

Рис.1.7.3. Схема электронных уровней и энергия возможных электронных переходов.
Различные электронные переходы требуют неодинаковой энергии, поэтому полосы поглощения располагаются при разных длинах волн.
Наибольшей энергии требует - переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области (
- переход, связанный с возбуждением внутренних электронов. Он соответствует поглощению в далекой ультрафиолетовой области (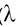 < 200 нм, Е > 600 кДж/моль). Такие переходы характерны, например, для
< 200 нм, Е > 600 кДж/моль). Такие переходы характерны, например, для
насыщенных углеводородов. Получить спектр в этой области непросто, поскольку здесь поглощают компоненты атмосферы; по этой причине поглощение одинарной связью не имеет большого значения в аналитической практике. Переход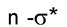 связан уже с меньшими затратами энергии;
связан уже с меньшими затратами энергии;
полосы, связанные с этим переходом, расположены в обычном ультрафиолете ( ~ 200 ^ 300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие
~ 200 ^ 300 нм). Еще меньшая энергия требуется для перехода на разрыхляющие  - орбитали. Переходы
- орбитали. Переходы 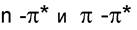 встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Такие функциональные группы, как
встречаются в молекулах соединений с сопряженными связями и молекулах ароматических соединений. Такие функциональные группы, как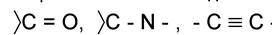 - и многие другие, всегда являются причиной поглощения в видимой и ультрафиолетовой областях. Их называют хромофорными группами.
- и многие другие, всегда являются причиной поглощения в видимой и ультрафиолетовой областях. Их называют хромофорными группами.
Этим же переходом можно объяснить, например, интенсивную окраску ионов MnO4 и CrO4 (переход с несвязы-вающей орбитали кислорода). Поскольку каждое вещество характеризуется своей системой энергетических уровней, то и спектры веществ различаются как по числу полос, так и по их положению на шкале длин волн.
можно объяснить, например, интенсивную окраску ионов MnO4 и CrO4 (переход с несвязы-вающей орбитали кислорода). Поскольку каждое вещество характеризуется своей системой энергетических уровней, то и спектры веществ различаются как по числу полос, так и по их положению на шкале длин волн.
Интенсивность поглощения. Интенсивность поглощения отражает значение молярного коэффициента в максимуме поглощения -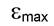 (см. раздел 1.6.). Существуют правила отбора (запрета), позволяющие заранее определить, какие из переходов не должны проявляться или должны быть неинтенсивными в спектрах.
(см. раздел 1.6.). Существуют правила отбора (запрета), позволяющие заранее определить, какие из переходов не должны проявляться или должны быть неинтенсивными в спектрах.
1. Запрещены переходы между энергетическими состояниями, характеризующимися различным спином (мультиплетностью). Наиболее интенсивные полосы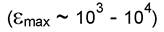 следует относить к синглетным переходам (переходам без изменения спина). Основное состояние почти всех органических соединений - синг-летное, и вероятность изменения спина при возбуждении электронов очень мала. 2.Запрещены переходы между электронными состояниями с одинаковой симметрией распределения заряда. Однако, вследствие воздействия колебаний ядер распределение электронов в основном и возбужденном состояниях может меняться. Это приводит к осуществлению слаборазрешенных переходов. Интенсивность полос поглощения соответствующих запрещенным по симметрии переходам мала.
следует относить к синглетным переходам (переходам без изменения спина). Основное состояние почти всех органических соединений - синг-летное, и вероятность изменения спина при возбуждении электронов очень мала. 2.Запрещены переходы между электронными состояниями с одинаковой симметрией распределения заряда. Однако, вследствие воздействия колебаний ядер распределение электронов в основном и возбужденном состояниях может меняться. Это приводит к осуществлению слаборазрешенных переходов. Интенсивность полос поглощения соответствующих запрещенным по симметрии переходам мала.
Данные о длине волны и интенсивности поглощения в максимуме могут служить лишь приблизительным критерием при идентификации вещества, причем на положение максимума влияют введение в молекулу заместителя, структурные особенности соединения, изменение внешних условий, например, замена растворителя. Если полоса смещается в сторону более длинных волн, говорят о батохромном сдвиге или углублении окраски; если полоса смещается в сторону коротких волн, эффект называют гипсохромным сдвигом.
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1266; Нарушение авторских прав?; Мы поможем в написании вашей работы!