
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионное произведение воды. Водородный показатель
|
|
|
|
Показатель рН был введен в практику в 1909 году датским химиком С.П. Зёренсеном.
Зачем он понадобился химикам?
Вода, как было отмечено ранее, слабый электролит. Без учета гидратации ионов Н+ уравнение диссоциации воды имеет вид:
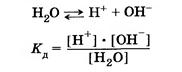
Концентрацию ионов обычно выражают в молях ионов на литр – моль/л. Опытным путем установлено, что в 1 литре воды при t = 220С диссоциации подвергается лишь 10-7 моль воды→ [ Н+ ] = 10-7 моль/л и [ ОН- ]= 10-7 моль/л.
Так как на ионы диссоциирует лишь незначительная часть молекул воды, то ее концентрацию [Н20] можно считать постоянной, и тогда
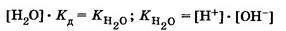
Произведение концентраций ионов водорода и гидроксид – ионов называется ионным произведением воды.
Кв = [ Н+ ] ∙ [ ОН- ] = 10-7∙10-7 =10-14
Кв = 10-14 – величина постоянная (!)
Ионное произведение воды дает возможность вычислить концентрацию гидроксид-ионов ОН- в любом водном растворе, если известна концентрация ионов водорода Н+, и наоборот.
Задача: Вычислите концентрацию гидроксид - ионов, если концентрация ионов водорода равна 10-3 моль/л
Дано: решение:
[ Н+ ] = 10-3 моль/л Кв = [ Н+ ] ∙ [ ОН- ]
_________________
[ ОН- ] -?[ ОН- ] = Кв ∕ [ Н+] = 10-14/ 10-3= 10-11моль/л
Ответ:[ ОН- ] = 10-11моль/л.
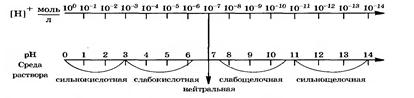
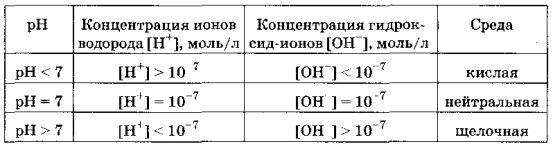
Различают три типа сред: нейтральную, щелочную, кислотную.
Нейтральная — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [Н+] = [ОН-] = 10 -7 моль/л
Кислотная — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [Н+] > [ОН-], [Н+] > 10-7 моль/л
Щелочная — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [Н+] < [ОН ], [Н+] < 10-7 моль/л
Кислотно-щелочной баланс можно выражать через концентрацию [ Н+ ] либо концентрацию [ ОН- ]. На практике прижился способ выражения кислотно – щелочного баланса через концентрацию ионов водорода.
Для удобства величину концентрацию ионов Н+ выравжают через – водородный показатель – рН.
Иными словами-
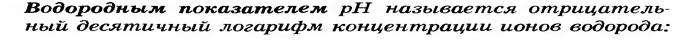
рН= -lg [ Н+ ]
Как решаются задачи по определению рН, я вам покажу на примере задачи: Определите рН раствора азотной кислоты, если молярная концентрация её раствора равна 0,01 моль/л?
Дано: НNO3= Н+ + NO3-
c(НNO3) = 0.01моль/л 1моль (НNO3) – 1 мольН+
рН(НNO3) -=? рН = --lg [ Н+ ] = -lg [ 10-2 ] = 2
0,01 = 10-2 Ответ: рН = 2, среда сильнокислая.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 1548; Нарушение авторских прав?; Мы поможем в написании вашей работы!