
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей
|
|
|
|
Соли – это ионные соединения, при попадании в воду они диссоциируют на ионы.. Процесс взаимодействие ионов соли с водой называется ГИДРОЛИЗОМ.
По отношению к воде соли можно разделить на 4 группы:
| AlCl3 | Na2CO3 | NaCl |
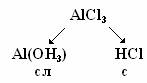 Соль образована катионом слабого электролита и анионом сильного электролита. Соль образована катионом слабого электролита и анионом сильного электролита.
| 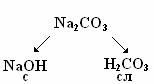 Соль образована катионом сильного электролита и анионом слабого электролита. Соль образована катионом сильного электролита и анионом слабого электролита.
| 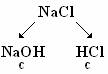 Соль образована катионом сильного электролита и анионом сильного электролита. Соль образована катионом сильного электролита и анионом сильного электролита.
|
| Сокращенное ионное уравнение | Соль гидролизу не подвергается | |
| Al3+ + H2O = (AlOH)2+ + H+ | CO32- + H2O = HCO3- + OH- | |
| Полное ионное уравнение | ||
| Al3+ + 3Cl- + H2O = (AlOH)2+ + H+ +3Cl- | 2Na+ + CO32- + H2O= 2Na+HCO3- + +OH- | |
| Молекулярное уравнение (I ступень) | ||
| AlCl3 + H2O = (AlOH)Cl2 + HCl | NaCO3 + H2O = NaHCO3 + NaOH | |
| Среда раствора | ||
| [H+] > [OH-] кислотная | [OH-] > [H+] щелочная | [H+] = [OH-] нейтральная |
Взаимный гидролиз двух солей.
Он происходит при попытке получить с помощью обменной реакции солей, которые в водном растворе полностью гидролизованы. При этом происходит взаимный гидролиз:
2 Al Cl3 + 3K2 S + 6 H2O à 2 Al(OH)3¯ + 3 H2S↑ + 6KCl
2Al3+ + 3S2- + 6HOH à 2 Al(OH)3 ¯ + 3 H2S↑
(Fe3+, Cr3+) (SO32-, CO32-) (SO2, CO2)
Какие факторы усиливают гидролиз?
1. Нагревание – при увеличении температуры равновесие смещается в сторону ЭНДОТЕРМИЧЕСКОЙ реакции – гидролиз усиливается;
2. Добавление воды – т.к. вода является исходным веществом в реакции гидролиза, то разбавление раствора усиливает гидролиз.
Как подавить процесс гидролиза?
Часто необходимо не допустить гидролиза. Для этого:
- Раствор делают максимально концентрированным (уменьшают количество воды);
- Для смещения равновесия влево добавляют один из продуктов гидролиза – кислоту, если идёт гидролиз по катиону или щёлочь, если идёт гидролиз по аниону.
Пример: как подавить гидролиз хлорида алюминия?
Хлорид алюминия AlCl3 – это соль, образованная слабым основанием и сильной кислотой – гидролизуется по катиону:
Al+3 + HOH ⇄ AlOH +2 + H+
Среда – кислая. Следовательно, для подавления гидролиза необходимо добавить еще кислоты. Кроме того, следует сделать раствор наиболее концентрированным.
Алгоритм написания гидролиза:
1. Рассмотреть состав соли, определить к какому типу солей по составу она относится.
2. Записать уравнение диссоциация соли (распада на ионы
3. Записать уравнение гидролиза иона, соответствующего слабому основанию или слабой кислоте.
4. Определить среду раствора (рН)
5. Записать уравнение гидролиза в молекулярной форме.
Количественно процесс гидролиза солей выражается степенью гидролиза - β
Степень гидролиза ( h ) — отношение числа гидролизованных молекул к общему числу растворенных молекул (%).
h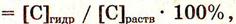
Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, повышении его температуры степень гидролиза увеличивается.
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесия процесса гидролиза.
Если соль образована слабой кислотой, то константа гидролиза равна отношению константы воды и константы диссоциации слабой кислоты (см. табл. 8 приложения).
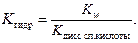
Если соль образована слабым основанием, то константа гидролиза равна отношению константы воды и константы диссоциации слабого основания.
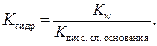
Если соль образована слабым основанием и слабой кислотой, то константа гидролиза равна отношению: в числителе – константа воды, а в знаменателе – произведение констант диссоциации слабой кислоты и слабого основания.
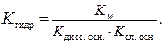
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2845; Нарушение авторских прав?; Мы поможем в написании вашей работы!