
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мозговой инсульт
|
|
|
|
Мозговым инсультом называют острое нарушение мозгового кровообращения, проявляющееся ишемией или геморрагией с развитием признаков очаговых или глобальных расстройств церебральных функций, неврологических симптомов, которые сохраняются свыше 24 ч после их возникновения, независимо от результатов нейровизуализации.
По характеру патологического процесса различают два вида инсульта: геморрагический и ишемический (мозговой инфаркт, размягчение мозга).
В течение последних десятилетий изменилась структура цереброваску-лярных заболеваний за счет явного преобладания ишемических инсультов над геморрагическими. В настоящее время соотношение кровоизлияния в мозг и инфарктов мозга составляет 1:4, а в некоторых регионах Украины 1:5.
Ишемический инсульт (инфарктмозга)
В МКБ-10 инфаркт головного мозга рассмотрен в рубрике 163, а инсульт неуточненный как кровоизлияние или инфаркт - в I 64. Как известно, ишемический инсульт (инфаркт мозга) может быть эмболическим, в большинстве случаев обусловленным кардиогенной или артерио-артериальной эмболией, а также неэмболическим (тромбоз, нетромботическое размягчение).
Классификация острых ишемических нарушений мозгового кровообращения (НМК) с учетом этиологических факторов была и остается важным критерием для выбора методов дифференцированного лечения больных. Современные достижения ангионеврологии свидетельствуют об этиологической гетерогенности ишемического инсульта:
· около 30-40 % случаев инфаркта мозга связано с атеросклеротиче-ским поражением магистральных артерий головы;
· около 20-25 % случаев инсульта вызвано кардиогенной эмболией;
· 25-30 % случаев ишемического инсульта составляет лакунарный инфаркт мозга как следствие гипертонических изменений сосудов;
· около 10 % случаев ишемического инсульта обусловлено гемореологи-ческими нарушениями, коагулопатиями;
· часто причину развития инсульта не удается точно выяснить.
Патогенез. Инфаркт мозга является следствием сложного комплекса процессов, которые вызывают развитие взаимосвязанных гемодинамиче-ских и метаболических расстройств, которые срабатывают вместе и возникают в определенном участке мозга. Он может быть обусловлен нарушением прилива крови в сосуды мозга, нарушением мозгового кровотока и затрудненным венозным оттоком. Венозные НМК имеют определенные патофизиологические и клинические особенности, которые, к сожалению, часто недооцениваются практическими врачами во время выбора дифференцированной терапии.
Среди многих механизмов, которые непосредственно вызывают ишеми-ческое нарушение мозгового кровообращения, ведущее место принадлежит тромбоэмболическим и гемодинамическим факторам. Т. е. ишемический инсульт может развиваться или в результате полной закупорки просвета сосуда тромбом или эмболом и перекрытия кровотока по нему, или по механизму сосудистой мозговой недостаточности, которая появляется в бассейне стенозируемого сосуда и усиливается в результате нарушения системной гемодинамики. Реализация патогенетических предпосылок в очаговую ишемию с развитием инфаркта мозга возникает в результате нарушения регионарных и системных механизмов компенсации мозгового кровообращения.
В основе формирования атеро- и тромбогенеза лежат различные механизмы. Имеют значение нарушения целостности и повышение проницаемости эндотелия интимы мозговых артерий, которые способствуют проникновению разных компонентов плазмы крови во внутреннюю оболочку сосудов. Это в свою очередь стимулирует процесс пролиферации гладкомышечных элементов соединительной ткани и обусловливает утолщение внутренней оболочки сосудов. Развитие атеросклероза в значительной мере зависит и от нарушений липидного обмена. Известно, что липопротеиды низкой и очень низкой плотности оказывают атерогенное действие, а липопротеиды высокой плотности - противоатерогенное.
В настоящее время доказано, что даже начальная стадия атеросклероза сопровождается изменениями функционального состояния тромбоцитов: повышением их агрегации и адгезивных свойств, угнетением дезагрегации. Пусковым механизмом адгезии тромбоцитов является повреждение эндотелия интимы в результате атероматозных изменений. Оно обусловливается также ишемией, механическими факторами, угнетением локального фибри-нолиза. Вследствие этого уменьшается индукция простациклина. Под воздействием физиологичных стимуляторов коллагена и тромбина возникает активизация тромбоцитов, синтезируются и высвобождаются метаболиты арахидоновой кислоты, в первую очередь тромбоксан А2, который повышает агрегацию тромбоцитов, других клеточных элементов крови.
Следовательно, соотношение между биологически активными веществами - простациклином и тромбоксаном А2 - определяет функциональное состояние тромбоцитов. Нарушение его может быть одной из причин, которые вызывают агрегацию тромбоцитов и процесс тромбообразования.
По данным Американской ассоциации врачей (1992 г.), в 30 % случаев инфаркт мозга обусловлен артерио-артериальной эмболией в результате распада атеросклеротических бляшек из сонных и позвоночных артерий, рыхлых без-фибриновых тромбов, агрегатами тромбоцитов. Кроме артерио-артериальной эмболии приблизительно в 20-25 % случаев ишемические нарушения мозгового кровообращения обусловлены кардиогенной эмболией, которая часто возникает при наличии эндокардита, пороков сердца, инфаркта миокарда, мерцательной аритмии. Во время операций на сердце, сосудах головы может наблюдаться воздушная эмболия. Жировая эмболия может наступить в случае травмы с переломами костей. Газовая эмболия возможна в результате накопления азота в крови во время быстрой декомпрессии и снижения атмосферного давления.
Кроме тромбоза и эмболии в развитии ишемического инсульта значительное место принадлежит гемодинамическим механизмам, в частности сосудистой мозговой недостаточности, срыву реакции ауторегуляции мозгового кровообращения, ангиодистоническим нарушениям в сосудах мозга (вазопарез, стаз), а также церебральным синдромам обкрадывания. На основании клинических и ангиографических данных, кроме описанного ранее подключичного синдрома обкрадывания, различают следующие синдромы ретроградного кровотока (варианты синдрома обкрадывания): каротидно-каротидный синдром, который возникает в случае закупорки внутренней сонной артерии, а компенсация кровообращения осуществляется за счет противоположной внутренней сонной артерии через переднюю соединительную артерию; синдром обкрадывания в системе сонных артерий, когда в случае закупорки общей сонной артерии и в результате более значительного снижения АД в наружной сонной артерии, чем во внутренней, возникает «эффект сифона» с обратным кровотоком из внутренней сонной артерии в наружную; каротидно-вертебралъный синдром, в случае которого симптомы поражения стволовой области мозга возникают при закупорке сосудов в системе сонных артерий; вертебрально-каротидный синдром обкрадывания, когда симптомы поражения каротидного бассейна наблюдаются в случае закупорки сосудов в вертебрально-базилярной системе; синдром обкрадывания по корковым анастомозам.
В патогенезе ишемического инсульта имеют значение также изменения физико-химических свойств крови, повышение ее коагуляции в мозговом кровообращении. Повышение вязкости цельной крови является одним из механизмов тромбообразования при вазопаретических нарушениях.
Относительно спазма мозговых сосудов, как возможного механизма развития ишемического инсульта, следует отметить, что его существование не вызывает сомнения и является важным звеном системы ауторегуляции мозгового кровообращения в ответ на значительное повышение системного АД и снижение концентрации углекислоты в крови. Однако роль нейрогенно обусловленного спазма мозговых сосудов в развитии инфаркта мозга признают далеко не все. Большинство исследователей не получили прямых доказательств роли его в возникновении церебральных ишемий.
Исключением является церебральный ангиоспазм, который развивается при наличии субарахноидального кровоизлияния и может приводить к развитию отсроченных инфарктов мозга, а также спазм мозговых сосудов при мигрени, обусловливающий развитие мигренозного инфаркта.
В патогенезе ишемического инсульта, наряду с локальными, имеют значение системные гемодинамические нарушения. Наиболее неблагоприятным является гипокинетический тип нарушения центрального кровообращения.
Патогенетическая классификация инфаркта мозга характеризует механизмы развития НМК, локализацию очага поражения, его размер. Согласно этой классификации различают такие формы инфаркта мозга:
· территориальный инфаркт, обусловленный тромботической или тром-боэмболической закупоркой крупного артериального русла; неврологическая симптоматика свойственна поражению основных сосудистых бассейнов;
· инфаркт в конечных ветвях крупных артерий мозга или в «пограничных зонах» участках, васкуляризированных дистальными артериями малого калибра из смежных сосудистых бассейнов; причиной возникновения этого варианта инфаркта в основном является снижение перфузионного давления, т. е. гемодинамический фактор;
· лакунарный инфаркт в области таламуса, внутренней капсулы, ствола мозга, мозжечка, или в белом веществе полушарий большого мозга, обусловленный локальными нарушениями кровотока в области микроангиопатий при артериальной гипертензии.
Использование новейших методов нейровизуализации позволило изучить очаговую церебральную ишемию и ее эволюцию на молекулярном уровне, способствовало накоплению принципиально новых фактов, разработке современных концепций патогенеза ишемического инсульта. Одной из них является концепция порогового ишемического кровотока.
Порог определяется критически низким уровнем мозгового кровотока (МК) и недостаточным поступлением кислорода. Наблюдается определенная последовательность возникновения метаболических расстройств в ответ на развитие острой фокальной ишемии мозга: первичная реакция возникает в случае снижения уровня МК ниже чем 55 мл/100 г в 1 мин и проявляется торможением синтеза белка. Снижение уровня МК ниже чем 35 мл/100 г в 1 мин стимулирует анаэробный гликолиз, ниже чем 20 мл/100 г в 1 мин вызывает избыточное высвобождение возбуждающих нейротрансмиттеров и обусловливает нарушение энергетического обмена. В случае уменьшения МК ниже чем 12-10 мл/100 г в 1 мин возникает аноксическая деполяризация клеточных мембран (К. Hossmann, 1996).
Выделяют нижний ишемический порог (энергетического повреждения) с кровотоком 12-10 мл/100 г в 1 мин, ниже которого не синтезируется АТФ, нарушается функция клеточных мембран, нейроны теряют калий, набирают кальций, натрий и осмотическим путем воду. Повышение концентрации кальция в нейронах активизирует мембранные фосфолипазы, способствует высвобождению сверхтоксичных жирных кислот, а следовательно является звеном многих процессов, которые в течение 6-8 мин от начала возникновения неврологического дефицита приводят к разрушению и гибели клеток мозга. В результате необратимых изменений нейронов формируется очаговый некроз, образуется зона инфарктного ядра.
С концепцией порогового ишемического кровотока тесно связана концепция так называемой ишемической полутени (ischemic penumbra).В течение первых часов после развития инсульта зону инфарктного эпицентра окружает пограничная область с кровотоком меньше чем 20 мл/100 г в 1 мин (верхний ишемический порог электрического поражения), ниже которого исчезают соматосенсорные ВП та ЭЭГ-активность, нарушается си-наптическая передача, но энергетический потенциал и функция ионных насосов сохраняются. Иначе говоря, структурно морфологическая организация нейронов этой зоны сохраняется, но имеется дефект их функциональной активности. Эту часть ишемизированного мозга называют «ишемическая полутень», или английским термином «пенумбра» (рис. 103). С клинической точки зрения значение этой зоны заключается в том, что нарушение функции нейронов в ней имеет обратимый характер, достигая 1-6 ч. Именно за этот участок мозговой ткани, собственно, и продолжается борьба, чтобы сохранить функцию нейронов.

Схематическое изображение зоны ишемии при инфаркте мозга:
1 - внутренняя сонная артерия; 2 - позвоночная артерия; 3 - передняя мозговая артерия; 4 - задняя мозговая артерия; 5 - тромб в средней мозговой артерии; 6 - очаг инфаркта - зона инфарктного ядра; 7 - ишемическая полутень; 8 - коллатеральное кровоснабжение
Длительность этой толерантности связана со степенью снижения мозговой перфузии. Повышение его в зоне ишемической полутени дает возможность возобновить нормальное функционирование нейронов этого участка, а снижение приводит к гибели клеток всех типов, включая не только нейроны, но и клетки нейроглии, которые выполняют опорную и другие вспомогательные функции. Следовательно, динамика в зоне полутени возможна в двух направлениях: или восстановление функции нейронов, или трансформация в инфаркт.
Существование ишемической полутени взаимосвязано с представлением о «терапевтическом окне». Это промежуток времени, в течение которого с наибольшей эффективностью могут проводиться терапевтические мероприятия. В основном он составляет 1 -6 ч от начала инсульта. Именно при своевременном лечении больного удается сохранить нейроны от разрушения.
Таким образом, использование новейших методических подходов позволяет выделить три степени поражения ткани мозга в результате ишемического инсульта: инфарктное ядро - участок критической перфузии и необратимого повреждения нейронов; ишемическая полутень (пенумбра) - участок вторичного повреждения с субкритической или «мизерной» перфузией и высоким риском развития инфаркта; коллатеральный участок умеренной гипоперфузии мозговой ткани с минимальной вероятностью развития инфаркта.
Ишемический каскад при остром инсульте. Современные концепции порогового ишемического кровотока и ишемической полутени позволили сместить акценты изучения патофизиологии ишемического инсульта от циркуляторных и метаболических нарушений в направлении к углубленному исследованию роли клеточных, патобиохимических и аутоиммунных механизмов в их повреждающем действии на ишемизированную ткань мозга. В настоящее время доказано значение молекулярных и генетических факторов в формировании инфаркта мозга.
Точные механизмы ишемического повреждения ткани мозга в случае снижения мозговой перфузии ниже верхнего ишемического порога (потери электрической функции нейронов) и нижнего порога энергетического повреждения клеток - еще полностью не выяснены. Среди причин гибели нейронов в зоне ишемической полутени ведущими считают взаимосвязанные патобиохимические и молекулярные механизмы, которые за короткий промежуток времени после развития ишемического инфаркта (первые 1-6 ч) формируют последовательные этапы ишемического каскада.
При снижении мозговой перфузии ниже верхнего ишемического порога с кровотоком ниже 20 мл /100 г в 1 мин возникает дефицит энергии для клеток ишемизированной ткани. Поскольку в энергетическом плане нейроны полностью зависят от адекватного поступления в клетки из кровотока глюкозы и кислорода, в цитоплазме нервных клеток возникает локальная активация гликолиза - анаэробного расщепления в цикле трикарбоновых кислот, за счет которого из одной молекулы глюкозы образуется лишь две молекулы АТФ вместе с молочной кислотой. Следовательно, путем гликолиза энергии образуется меньше (в 18 раз), чем в случае аэробного окисления такого же количества глюкозы, которое происходит в митохондриях в цикле трикарбоновых кислот (Кребса). В таких условиях возникает резкое снижение содержания глюкозы в эпицентре ишемического очага и увеличение на периферии от него.
Острая ишемия вызывает избыточную продукцию нейронами глутамата и других возбуждающих экзайтотоксинов и избыточное высвобождение их из аксональных терминалей; в результате снижения обратного внутриклеточного захвата нейромедиаторных аминокислот возникает глутаматная экзайтотоксичность (от англ. to excite - возбуждать). В обычных условиях глутамат является возбуждающим медиатором и содержится во многих нейронах мозга, которые выделяют его в результате деполяризации наружных мембран. В здоровой ткани мозга нейроны и клетки нейроглии поглощают лишний глутамат из межклеточного пространства, но клетки ишемической полутени не имеют для этого энергии (тканевой АТФ).
В результате связывания глутамата с инотропными рецепторами N-метил-D-аспартата, метаболотропными и АМРА-рецепторами открываются кальциевые каналы, возникает массивное вхождение внутрь нейронов ионов Са2+, который обусловливает Са2+-индуцированную экзайтотоксичность. Нервные клетки теряют калий, накапливают ионы натрия, что, как правило, сопровождается увеличением воды в них, возникает набухание клеток - цитотоксический отек ткани мозга, нарушаются механизмы синаптической передачи, которые на этом этапе еще имеют обратимый характер. В результате увеличения концентрации положительных ионов внутри клетки изменяются электрические свойства нейронов.
Уменьшение мозговой перфузии ниже нижнего ишемического порога (энергетического поражения нейронов) с кровотоком < 10 мл /100 г в 1 мин приводит к снижению продукции высокоэнергетических фосфатов (АТФ) и нарушению функции ионных насосов энергозависимых клеточных мембран (потенциалзависимые Са2+-каналы, натрий-калиевый насос), что вызывает дополнительное массивное поступление внутрь клеток ионов кальция, натрия, хлора из внутриклеточных депо и внеклеточного пространства; в результате уменьшения разницы потенциалов между внутриклеточной и внеклеточной средой возникает массивная аноксическая деполяризация мембран, которую считают основным критерием необратимого повреждения клеток. Эту степень ишемизации ткани мозга считают порогом потери клеточного ионного гомео-стаза. Нарушается функция митохондрий, в которых осуществляются процессы окисления и фосфорилирования с образованием высокоэнергетических фосфатов. Снижение их продукции стимулирует образование свободных радикалов, а высокая их токсичность обусловливает развитие цитотоксичности.
Избыточное накопление в клетках ионов кальция и резкое усиление окислительного процесса вызывает синтез оксида азота (NO), а нарушение баланса между продукцией реактивных форм кислорода (свободных радикалов) и способностью системы антиоксидантной защиты их элиминировать приводит к развитию оксидантного стресса нейронов - одного из универсальных механизмов поражения ткани мозга.
Взаимодействие избыточного кальция с оксидом азота и энзимной системой вызывает активацию внутриклеточных ферментов (фосфолипазы, протеинкиназ), гидролиз фосфолипидов клеточных мембран до свободных жирных кислот арахидоновой кислоты, цикл которой катализируется ферментом циклогеназой-2 (ЦОГ-2). Каскад этих превращений вызывает избыточную продукцию высокореактивного супероксид радикала (О2-), пероксинитрита, продуктов метаболизма (простагландины, тромбоксан-А2, простациклин, лейкотриены, липопероксиды, провоспалительные цитоки-ны), что приводит к ослаблению защитных систем и расщеплению внутриклеточных структур (ДНК, белков, фосфолипидов), разрушению цитоске-лета, а следовательно и к необратимому поражению нейронов.
Активированная ишемией микроглия, астроциты, нейроны усиливают секрецию нейротоксических медиаторов воспаления (провоспалительных цитокинов), возникает вторичная реакция локального воспаления, которая опосредована также экспрессией генов, кодирующих факторы местного воспаления. Она начинается с прилипания полиморфноядерных лейкоцитов к эндотелию сосудов и приводит к микроциркуляторным нарушениям, тромбообразованию и расширению зоны инфаркта. Воспалительный каскад увеличивает проницаемость ГЭБ, миграцию активированных лейкоцитов из сосудистого русла в зону очага ишемии, что усиливает реакцию местного воспаления. Оксидантный стресс клеток и воспалительный каскад достигают максимума через 12-36 ч.
Активируются «гены гибели клеток», ответственные за развитие апоп-тоза или так называемой запрограммированной смерти клеток ишемической полутени. Зона инфаркта в таком случае расширяется за счет участка ишемической полутени.
Первичная зона инфаркта регистрируется через 3-6 ч. После 6 ч с момента развития первых неврологических симптомов заканчивается формирование большей части инфаркта мозга. «Доформирование» очага продолжается в течение 24-48 ч, а возможно, и позже в зависимости от степени уменьшения объема мозгового кровотока и других последствий ишемии. После 24-48 ч размеры инфаркта практически не изменяются.
Таким образом, ишемический каскад - это ряд взаимосвязанных нейрохимических процессов, спровоцированных окклюзией и прекращением поступления энергетических ресурсов (кислорода, глюкозы) в клетки мозга. Он преимущественно возникает в пределах ишемической полутени. Ранние проявления ишемического каскада включают такие патобиохимические нарушения, как активацию глутаматных рецепторов, накопления нейронами внутриклеточного Са2+, развитие Са2+-индуцированной экзайтотоксич-ности. При отдаленных последствиях ишемического каскада происходят локальные воспалительные изменения, образуются реактивные формы кислорода, связанные с потерей электронов, возникают неуправляемая и некомпенсированная продукция свободных радикалов, ослабление эндогенной системы антиоксидантной защиты нейронов, инициируется апоптоз.
Следовательно, по современным представлениям, ведущее место в патогенезе ишемического инсульта принадлежит сложному комплексу ишемическо-воспалителъно-тромботическш нарушений, которые тесно связаны между собой и срабатывают вместе. Каждый из этапов повреждения ткани мозга сопровождается выделением токсических для эндотелиальных клеток веществ (свободных радикалов - продуктов пероксидного окисления). Исходя из этого, считают, что ишемический инсульт - «...это ничто иное, как ишемический стресс для ткани мозга».
В настоящее время известны два вида смерти клеток: некроз и апоптоз. Некроз (от грец. nekros - мертвый) возникает в результате прямого влияния патогенного фактора (микроорганизм, ишемия и др.), который нарушает целостность мембраны клеток. Это обусловливает выброс индукторов воспаления и миграцию иммунных клеток к очагу поражения. В области поврежденной клетки развиваются септическое или асептическое воспаление, набухание нейронов.
Возникают характерные изменения в ядре и цитоплазме. Ядро сморщивается, наблюдается конденсация хроматина (кариопикноз), а следовательно он распадается на глыбки (кариорексис) и растворяется (кариолизис). В цитоплазме наступает денатурация и коагуляция белков, распадаются мембранные структуры. Нарушаются окислительно-восстановительные процессы и синтез АТФ в митохондриях, клетка страдает от дефицита энергии. Постепенно она распадается на отдельные глыбки, которые захватываются и поглощаются макрофагами. На месте функционально активной клетки формируется соединительная ткань.
Апоптоз (от греч. аро - отделение + ptosis падение) по морфологическим признакам существенно отличается от некроза и имеет некоторые специфические особенности. Инициирует апоптоз увеличивающаяся экспрессия генов - индукторов апоптоза (или угнетение генов-ингибиторов) либо повышенное внутриклеточное накопление кальция. В отличие от некроза в случае апоптоза не поражаются внутриклеточные мембранные структуры, не возникает воспалительная реакция. Элементы цитоплазмы поглощаются смежными клетками или тканевыми макрофагами. На месте погибшей клетки соединительная ткань не формируется.
Таким образом, формирование инфаркта мозга происходит двумя механизмами: некротической гибели клеток и апоптоза - генетически запрограммированной смерти клеток.
Патоморфология. Полная закупорка сосуда, который кровоснабжа-ет определенный участок мозга, приводит к необратимым изменениям нейронов, их гибели в течение 6-8 мин, т. е. возникает очаговый некроз мозга. Эти два взаимосвязанных фактора - порог времени и морфологические изменения - подтверждают классическую концепцию, что среди соматических органов головной мозг особенно высокочувствителен к гипоксии, наиболее уязвим в условиях ишемии.
Инфаркт может возникать в различных отделах головного мозга. Чаще всего (до 75 %) он развивается в подкорково-капсулярной области, т. е. в бассейне средней мозговой артерии. На втором месте по частоте стоит инфаркт, который локализуется в стволовой части мозга, которую обеспечивают кровью артерии вертебрально-базилярного бассейна. Локализация инфаркта мозга в значительной мере обусловлена его патогенезом, а также темпом развития. Инфаркт, который возникает в связи с сосудистой мозговой недостаточностью, обычно развивается в коре большого мозга. Чаще это происходит в участках соединения периферических ветвей средней мозговой артерии с территориями кровоснабжения передней и задней мозговых артерий (зоны смежного кровообращения). Иначе говоря, это инфаркт, который развивается в «пограничной зоне» по принципу «последнего луга» (К. Цюльх, 1955). Размеры зоны инфаркта могут быть разные: от мелкого очага до большого; последний охватывает корково-подкорково-капсулярную область мозга. Такой инфаркт часто наблюдается при наличии закупорки ствола средней мозговой артерии или интракра-ниального отдела внутренней сонной артерии (территориальный инфаркт).
Различают белый, красный (геморрагический) и смешанный инфаркт мозга. Белый, или серый, инфаркт составляет 85-90 % случаев ишемического инсульта, смешанный - 5-10 %, еще реже наблюдается красный инфаркт. Белый инфаркт возникает в разных участках головного мозга. На начальной стадии его формирования под микроскопом видно набухание нервны! клеток, бледность протоплазмы при закрашивании клеток, их цитолиз. Обнаруживают также значительное количество ишемически измененных ганглиозных клеток. В последующем в центре очага формируется некроз с повреждением нейронов, клеток нейроглии и сосудов. Вещество мозга в области инфаркта превращается в кашеобразную массу серого цвета. Процесс заканчивается образованием рубца и полости, наполненной серозной жидкостью.
Красный инфаркт развивается только в сером веществе мозга, в первую очередь в коре, несколько реже - в подкорковых узлах, мозжечке и не образуется в белом веществе мозга. Красный инфаркт - это очаг красного цвета, желеобразной консистенции, чем напоминает кровоизлияние по типу геморрагического пропитывания. Однако механизм развития красного инфаркта может быть различным. Возникновению геморрагической трансформации инфаркта всегда предшествует ишемия, затем присоединяется кровоизлияние в ишемизирован-ную ткань и формируется геморрагический инфаркт или инфаркт-гематома. Во время микроскопического исследования очага обнаруживают большое количество клеток, измененных по ишемическому типу. Геморрагический инфаркт всегда имеет четкую границу. Кровоизлияние типа геморрагического пропитывания - это мелкий по размеру очаг красного цвета, который не имеет четкой границы. В очаге кровоизлияния по типу геморрагического пропитывания признаки ишемии, как правило, отсутствуют. Они никогда не развиваются в коре и мозжечке, а обычно локализуются в области таламуса и моста.
К смешанным формам принадлежат такие нарушения мозгового кровообращения, которые на одних участках являются ишемическими, а на других - геморрагическими. Причем геморрагии развиваются в сером веществе мозга или в внепаренхиматозном пространстве (субарахноидальное и/или желудочковое кровоизлияние).
Клиника. В зависимости от темпа формирования и длительности неврологического дефицита Комитет экспертов ВОЗ по сосудистой патологии мозга рекомендует различать следующие клинические формы острых ише-мических нарушений мозгового кровообращения:
· транзиторные ишемические атаки (ТИА);
· пролонгированные ишемические атаки с обратимым развитием (Prolonged reversible Ishemic Attaks), или малый инсульт (minor stroke):
· прогрессирующий ишемический инсульт (stroke-in-evolution);
· завершенный (тотальный) ишемический инсульт (major stroke).
ТИА характеризуются очаговыми неврологическими нарушениями, включая монокулярную слепоту (amaurosis fugax), которые полностью исчезают в течение 24 ч после их возникновения. Чаще всего они длятся от 10 до 60 мин. В случае выявления на КТ или МРТ очаговых изменений ткани мозга даже при условии регресса неврологических нарушений в пределах одних суток после их возникновения используют термин «ТИА с наличием инфаркта на КТ/МРТ».
Малый инсульт (minor stroke) отвечает определению экспертов ВОЗ: «пролонгированные ишемические атаки с обратимым неврологическим дефицитом», это вариант ишемического инсульта, при котором восстановление неврологических функций завершается в пределах от 2 до 21 сут.
Прогрессирующий ишемический инсульт (stroke-in-evolution) характеризуется постепенным развитием общемозговых и очаговых симптомов в течение нескольких часов или 2-3 сут с последующим неполным восстановлением функций в течение до 30 сут. У больного может оставаться минимальная неврологическая симптоматика, которая не влияет на функциональное состояние организма. Эту клиническую форму НМК некоторые авторы определяют как «инсульт с минимальной остаточной симптоматикой», или «strokes with minimum residium».
Завершенный (тотальный) ишемический инсульт (major stroke) характеризуется стабильным или не полностью регрессирующим неврологическим дефицитом.
Ишемический инсульт возникает преимущественно у лиц средних и преклонных лет, но иногда может развиваться и у лиц молодого возраста. Заболевание возникает в любое время суток, но чаще всего во время сна или сразу после него. В отдельных случаях ишемический инсульт возникает после физической нагрузки, психоэмоционального перенапряжения, употребления алкогольных напитков. Нередко развитию инфаркта мозга предшествуют ТИА.Самым характерным для ишемического инсульта является постепенное, в течение нескольких часов, иногда 2-3 сут, нарастание очаговых неврологических симптомов. Иногда наблюдается мерцающий тип неврологических симптомов, когда степень их проявления изменяется. Приблизительно в 1/3 случая заболевание развивается остро, апоплектиформно. Значительно реже отмечается псевдотуморозное развитие инфаркта мозга, когда очаговые симптомы нарастают в течение нескольких недель.
Характерным признаком ишемического инсульта является преобладание очаговых неврологических симптомов над общемозговыми, которые иногда отсутствуют. Очаговая симптоматика в случае инфаркта мозга определяется локализацией ишемии, сосудистым бассейном, в котором произошло нарушение мозгового кровообращения. Сознание обычно сохраняется или иногда бывает нарушенным по типу легкого оглушения. Значительные нарушения сознания с развитием сопора или коматозного состояния наблюдаются лишь в случае локализации инфаркта в полушариях большого мозга, который сопровождается значительным отеком головного мозга и вторичным дислокационно-стволовым синдромом. Это в большинстве случаев возникает при закупорке внутренней сонной артерии в интракраниальном отделе или основного ствола средней мозговой артерии. Потеря сознания отмечается также в случае ишемического инсульта в сосудах вертебрально-базилярного бассейна.Вегетативные нарушения и менингеальные симптомы в начальный период ишемического инсульта не возникают. Они могут выявляться во время развития отека мозга. У многих больных развиваются признаки сердечной недостаточности. Часто регистрируются нарушения ритма сердца. АД нормальное или сниженное, но чаще наблюдается артериальная гипертензия.
Классификация инфаркта мозга по степени его тяжести предусматривает следующие клинические формы течения заболевания:
· инсульт легкой степени тяжести с незначительным неврологическим дефицитом, который регрессирует в течение 3 нед после его возникновения (вариант малого инсульта или лакунарного инфаркта мозга);
· ишемический инсульт средней степени тяжести, клиническая картина характеризуется преобладанием очаговых неврологических симптомов над общемозговыми, без нарушения сознания и признаков отека головного мозга;
· тяжелый ишемический инсульт, течение которого сопровождается общемозговыми симптомами, нарушениями сознания, грубым неврологическим дефицитом, признаками отека головного мозга, часто вторичным дислокационно-стволовым синдромом.
Инфаркт в системе внутренней сонной артерии.Частота инфаркта мозга в каротидном бассейне в 5 6 раз превышает таковую в вертебрально-базилярном бассейне. Он обусловлен закупоркой экстра- или интракраниального отдела внутренней сонной артерии, а также гемодинамически значимым стенозом.
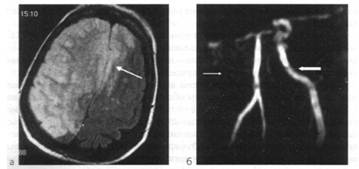
Острый ишемический территориальный инфаркт в бассейне правой внутренней сонной артерии (исследование выполнено через 47 ч от начала заболевания):
а - МРТ головного мозга (аксиальная плоскость, срез на уровне полушарий мозга, Т2TIPM-взвешенное изображение): визуализируется большой гиперинтенсивный очаг инфаркта, занимающий все правое полушарие большого мозга и переднюю часть лобной области противоположного полушария (показано стрелкой); б - МРА магистральных сосудов головного мозга: выявлена окклюзия правой внутренней сонной артерии, о чем свидетельствует отсутствие MP-сигнала (показано тонкой стрелкой), левая внутренняя сонная артерия определяется четко (показано толстой стрелкой)
Для тромбоза внутренней сонной артерии в экстракраниальном отделе характерным является развитие гемипареза в сочетании с центральными парезами мимических мышц и языка, нарушением чувствительности, дефектами поля зрения на стороне, противоположной очагу поражения.
В случае локализации очага в левом полушарии наблюдаются расстройства речи по типу моторной афазии, нарушения других высших корковых функций (апраксия, акалькулия, анозогнозия, аутотопоагнозия) отмечаются редко.
Снижение остроты зрения или слепота на стороне закупорки в сочетании с гемипарезом на противоположной стороне являются важным признаком поражения внутренней сонной артерии (оптикопирамидный синдром Ласко-Ра-довича). Часто обнаруживают гомолатеральный синдром Бернара-Горнера в результате поражения симпатических волокон в оболочке сонной артерии.
В случае интракраниальной закупорки внутренней сонной артерии наряду с гемиплегией и гемианестезией (с противоположной стороны) отмечаются выраженные общемозговые симптомы: головная боль, рвота, нарушение сознания, психомоторное возбуждение, вторичный стволовой синдром.
Ишемический инсульт, обусловленный гемодинамически значимым стенозом экстракраниального отдела внутренней сонной артерии, характеризуется «мерцанием» симптомов: слабость конечностей, онемение в них, афазия, снижение зрения на один глаз. Нередко им предшествуют ТИА. Обнаруживают асимметрию пульсации сонных артерий, систолический шум над артерией. По клиническому течению различают такие клинические формы ишемических нарушений кровообращения в бассейне внутренней сонной артерии:
· острую апоплексическую форму с внезапным началом;
· подострую форму, которая развивается медленно в течение нескольких часов или 1-2 сут;
· хроническую псевдоту морозную форму, которая характеризуется медленным (в течение дней или недель) нарастанием симптомов.
Инфаркт в бассейне средней мозговой артерии. Закупорка средней мозговой артерии может возникать на разных уровнях, что в значительной мере обусловливает клиническую картину инфаркта в каждом конкретном случае.
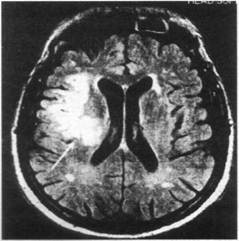
МРТ головного мозга больного с острым территориальным инфарктом правой лобно-височной области через 22 ч от начала заболевания (Т2ТИРМ-взвешенное изображение, аксиальная плоскость, срез на уровне тел боковых желудочков):
в правых лобной и височной долях визуализируется неправильной формы гиперинтенсивный очаг инфаркта однородной структуры с четкими контурами (показано стрелкой)
Поражение ствола средней мозговой артерии проявляется гемиплегией, гемианестезией, гемианопсией на противоположной относительно очага поражения стороне тела. Наблюдаются также парез взора, при локализации очага поражения в левом полушарии нарушения речи (моторная или тотальная афазия), а при инфаркте в правом полушарии апрактоагностиче-ский синдром.
При наличии инфаркта в бассейне глубоких ветвей средней мозговой артерии развиваются спастическая гемиплегия, центральный парез мышц лица и языка, иногда - нарушения чувствительности на стороне, противоположной очагу. Поражение левого полушария головного мозга может привести к моторной афазии.
Если очаг поражения локализуется в бассейне корковых ветвей средней мозговой артерии, наблюдаются двигательные нарушения, нарушения чувствительности, преимущественно в верхней конечности, гемианопсия, а также сенсомоторная афазия, аграфия, алексия, акалькулия при локализации инфаркта в левом полушарии. При локализации инфаркта в правом полушарии отмечаются анозогнозии, нарушения схемы тела.
Инфаркт в бассейне передней мозговой артерии характеризуется парезом нижней конечности или гемипарезом с преимущественным поражением нижней конечности на противоположной стороне. Закупорка парацентральной ветви обусловливает монопарез стопы, который напоминает периферический парез. Могут наблюдаться задержка или недержание мочи. Возникают рефлексы орального автоматизма и хватательные феномены, патологические стопные сгибательные рефлексы: Россолимо, Бехтерева, Жуковского. Характерные изменения психического состояния, обусловленные поражением лобной доли полушария: снижение критики, памяти, немотивированное поведение. Эти изменения значительны в случае возникновения двусторонних очагов инфаркта в бассейне передних мозговых артерий. При левосторонней локализации инфаркта может наблюдаться апраксия левой верхней конечности.
Инфаркт в бассейне вертебрально-базилярных сосудов. Поражение артерий вертебрально-базилярного бассейна обусловливает развитие инфаркта в области стволового отдела, затылочной доли головного мозга, таламуса и мозжечка. Он характеризуется полиморфностью клинических проявлений и течения.
Инфаркт в бассейне задней мозговой артерии. Очаг инфаркта в бассейне корковых ветвей задней мозговой артерии клинически проявляется зрительными нарушениями: гомонимной гемианопсией с сохранением центрального зрения или квадрантной гемианопсией. Наблюдаются также зрительная агнозия, явления метаморфопсии. В случае левосторонней локализации поражения могут возникать алексия, сенсорная и семантическая афазия. Распространение ишемии на медиобазальные отделы височной доли обусловливает возникновение нарушения памяти типа корсаковского синдрома, эмоционально аффективных нарушений. Поражение ветвей задней мозговой артерии, которые васкуляризируют кору теменной доли на границе с затылочной, приводит к разнообразным корковым синдромам: дезориентации в месте и времени, нарушению оптико-пространственного гнозиса.

МРТ головного мозга на 4-й день от начала инсульта:
а - гиперинтенсивные участки на T1-взвешенном изображении (показано стрелкой); б - гипоинтенсивные участки на Т2-взвешенном изображении (показано стрелкой) соответствуют геморрагическому инфаркту в затылочно-теменном участке левого полушария головного мозга
Возникновение инфаркта в бассейне глубоких ветвей задней мозговой артерии, которые обеспечивают кровью значительную часть таламуса, задний отдел гипоталамуса, утолщения мозолистого тела, зрительную лучистость, обусловливает развитие таламического инфаркта (рис. 107). Последний клинически характеризуется развитием синдрома Дежерина-Русси, сопровождающийся гемианестезией, гиперпатией, гемиалгией, гемиатакси-ей, гемианопсией, преходящим гемипарезом на стороне, противоположной очагу поражения. Возможны вегетативные и трофические нарушения. Иногда возникают атаксия, интенционный тремор в противоположных конечностях (верхний синдром красного ядра). Может возникнуть гиперкинез хореоатетозного типа или гемибализм, «таламическая» рука.
Инфаркт в бассейне основной (базилярной) артерии. Как известно, от основной артерии отходят ветви, которые обеспечивают кровью мост, мозжечок, и продолжается она двумя задними мозговыми артериями. Поэтому при закупорке основной артерии возникают симптомы поражения моста, среднего мозга, гипоталамуса, мозжечка, иногда присоединяются симптомы, обусловленные повреждением корковых отделов затылочных долей мозга.
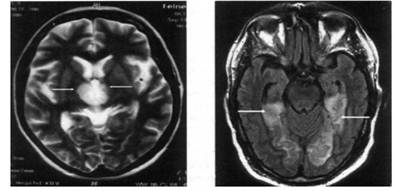
| MPT головного мозга на 3-й день от начала инсульта (Т2-взвешенное изображение, аксиальная плоскость): двусторонний таламический инфаркт; на уровне подкорковых структур визуализируются симметричные (больше справа) гиперинтенсивные большие светлые участки в таламусе (показано стрелками), которые отвечают ишемическому инфаркту | МРТ головного мозга больного через 24 ч от начала заболевания (Т2ТИРМ-взвешенное изображение): симметрично с обеих сторон визуализируются большие гиперинтенсивные очаги инфаркта в медио-височно-затылочных областях головного мозга (показано стрелками) |
Клиническая картина острой закупорки основной артерии характеризуется потерей сознания, глазодвигательными нарушениями, обусловленными поражением III, IV, VI пар черепных нервов, развитием тризма, тетрапареза или тетра-плегии, нарушениям мышечного тонуса (кратковременная децеребрационная ригидность, горметонические судороги, которые сменяются мышечной гипо- и атонией). Наблюдаются мозжечковые симптомы, иногда «корковая слепота», а также двусторонние патологические рефлексы. Отмечаются гипертермия, нарушения витальных функций. Исход заболевания в большинстве случаев легален.
Инфаркт в области моста может возникать также при закупорке ветвей основной артерии. Клиническая картина его вариабельна и зависит от уровня поражения сосуда. В случае закупорки парамедианных артерий моста возникает контралатеральный гемипарез, который сочетается с периферическим парезом мышц лица, а также с мостовым параличом взора (глаза смотрят на парализованные конечности) или парезом наружных прямых мышц глаза. На стороне очага поражения может наблюдаться также изо лированный парез мимических мышц по периферическому типу (альтернирующий синдром Фовилля). Нередко выявляется альтернирующая гемиги-пестезия нарушения болевой и температурной чувствительности на лице на стороне поражения и на туловище на противоположной стороне.
Двусторонний инфаркт в бассейне парамедианных артерий характеризуется развитием тетрапареза, псевдобульбарного синдрома и мозжечковых симптомов. При инфаркте в бассейне артерии четверохолмия возникают паралич взора кверху и парез конвергенции (синдром Парино), которые сочетаются с нистагмом. Инфаркт в области ножки мозга проявляется развитием альтернирующего синдрома Вебера (паралич мышц, которые иннервируются глазодвигательным нервом, с гемиплегией и гемианестезией на контралатеральной стороне).
Инфаркт в бассейне позвоночной артерии. Позвоночная артерия обеспечивает кровью продолговатый мозг, мозжечок, частично - шейный отдел спинного мозга. Поражение ее может возникать на уровне экстра- или интракраниального отделов. В случае закупорки экстракраниального отдела позвоночной артерии наблюдаются кратковременная потеря сознания, системное головокружение, нарушение слуха, зрения, глазодвигательные и вестибулярные нарушения, изменения статики и координации движений. К этим симптомам присоединяются парез конечностей, нарушения чувствительности. Могут возникать приступы внезапного падения с потерей мышечного тонуса. Нередко отмечаются вегетативные изменения, гиперсом-ния, нарушения дыхания, сердечной деятельности.
Закупорка интракраниального отдела позвоночной артерии чаще проявляется развитием альтернирующего синдрома Валленберга Захар-ченко, обусловленного поражением нижней задней мозжечковой артерии. Наблюдаются системное головокружение, рвота, нистагм. В таком случае симптомы поражения пирамидного пути отсутствуют или слабо выражены. При двустороннем поражении позвоночной артерии возникают бульбарный синдром, нарушения дыхания, сердечной деятельности. К этим симптомам присоединяется парез конечностей. Если развитие заболевания острое, развиваются потеря сознания, глубокая кома.
Подтипы ишемического инсульта. По механизму развития различают такие подтипы ишемического инсульта: атеротромботический, кардиоэм-болический, лакунарный, гемодинамический, гемореологический; часто причины и механизмы развития инсульта точно установить не удается (32 %).
Атеротромботический инсульт. Около 30-40 % случаев ишемического инсульта обусловлены атеросклеротическим поражением магистральных артерий головы. Причем у европейцев атеросклеротические бляшки значительно чаще наблюдаются в экстракраниальных сосудах головы, чем в интрацеребральных артериях. Чаще они поражают артерии большого и среднего калибра в местах деления, извитости или слияния. В то же время у жителей Японии, Китая, Афро-Карибского бассейна атеросклеротические бляшки в интракраниальных артериях встречаются относительно чаще, чем в экстракраниальных сосудах (Ч. П. Ворлоу и соавт., 1998).
Атеротромботический инсульт в большинстве случаев обусловлен ате-росклеротическим процессом в экстра- и/или интракраниальных артериях, что обусловливает их стеноз, закупорку, тромбоз; нестабильная атеросклеротическая бляшка с неравной поверхностью может вызвать развитие артерио-артериальной эмболии. Для тромбоза внутренней сонной артерии (ВСА) в экстракраниальном отделе характерным является развитие перекрестного оптико-пирамидного синдрома Ласко-Радовича: снижение остроты зрения или слепота на стороне закупорки в сочетании с гемипаре-зом на противоположной стороне. Могут возникать эпилептические приступы преимущественно коркового типа. Закупорка ВСА внутри черепа чаще возникает дистальнее отхождения глазной артерии, в большинстве случаев может распространяться до артериального круга большого мозга в среднюю и переднюю мозговую артерии, что приводит к развитию территориального инфаркта большого мозга. Клиническое течение ишемического инсульта, обусловленного гемодинамически значимым стенозом экстракраниального отдела ВСА, характеризуется слабостью конечностей, их онемением, афати-ческими нарушениями, снижением зрения одного глаза.
Кардиоэмболический инсульт. Приблизительно в 23-25 % случаев ишемические нарушения мозгового кровообращения обусловлены кардиогенной эмболией, которая часто возникает при свежем инфаркте миокарда, мерцательной аритмии, фибрилляции предсердий, пролапсе митрального клапана, дилатационной кардиомиопатии, эндокардите, во время операций на сердце (внутрисердечные шунты). Наличие потенциального источника эмболии не значит, что именно оно вызвало инсульт; значительная часть пациентов имеют не одну, а несколько причин эмболии.
Кардиоэмболический инсульт развивается внезапно, без всяких предвестников. Возможна потеря сознания. Чаще всего поражается бассейн средней мозговой артерии (СМ А; см. рис. 97). Закупорка ее может возникать на разных уровнях, что в значительной мере обусловливает клиническую картину инфаркта в каждом конкретном случае. Поражение главного ствола СМ А до отхождения от нее глубоких ветвей приводит к развитию территориального (большого) инфаркта (см. рис 105), который проявляется гемиплегией, гемианестезией, гемианопсией, на противоположной относительно очага поражения стороне тела. При инфаркте в бассейне глубоких ветвей СМ А развивается подкорково-капсулярный инфаркт в большинстве случаев среднего размера. Поражение корковых ветвей сосудов приводит к развитию поверхностного инфаркта с преимущественным нарушением функции верхней конечности, изменением чувствительности. В случае локализации очага инфаркта в левом полушарии нарушаются высшие мозговые функции (афазия, апраксия, агнозия).
Эмболия сосудов мозга сердечного происхождения характеризуется быстрым регрессом очаговых симптомов (синдром, который исчезает на глазах), одновременным или последовательным возникновением инфаркта в разных артериальных бассейнах: в обоих полушариях, сочетанного в каротидном и вертебрально-базилярном бассейнах или двустороннего многоочагового. Для инсульта кардиального происхождения характерна ранняя реканализация интракраниального сосуда, в случае поздней реперфузии (более 6 ч от начала инфаркта) - геморрагическая трансформация инфаркта: асимптомная (пете-хиальный, геморрагический инфаркт) или симптомная (инфаркт-гематома).
Лакунарный инфаркт (ЛИ) мозга это особая форма острого или медленно прогрессирующего ишемического нарушения мозгового кровообращения на фоне артериальной гипертензии, обусловленная первичным поражением перфоративных артерий. Характеризуется развитием мелких очагов некроза в глубоких отделах мозга. В процессе организации из них формируются небольшие по размеру (0,5-1 см) полости круглой или неправильной формы - лакуны.
Термин «лакуна» (от франц. lacune - озерцо, или lacunair - полость) вошел в медицину после того, когда Дюран-Фандель (1843), а впоследствии П. Мари (1901) обнаружили в головном мозге людей пожилого возраста большое количество мелких полостей - лакун - и впервые описали клиническое течение этой патологии. Подробнее проявления ЛИ мозга описал М. Фишер (1965). При большом количестве ЛИ в обоих полушариях большого мозга формируется лакунарное состояние мозга (status lacunaris) как проявление гипертензивной ангиоэнцефалопатии. Одновременно с термином «лакунарный инфаркт» некоторые авторы применяют как синоним термин «лакунарный инсульт».
Ведущим фактором риска развития ЛИ является артериальная гипер-тензия. Сахарный диабет часто сочетается с артериальной гииертензией, повышая вероятность развития ЛИ мозга.
Патогенез. ЛИ мозга формируется в результате причин, которые обусловливают локальный дефицит мозгового кровообращения и цирку-ляторную гипоксию. Следует особенно отметить патогенетическую связь ЛИ с артериальной гипертензией. Считают, что к развитию ЛИ приводят процессы, которые сопровождают артериальную гипертензию и вызывают облитерацию мелких перфоративных артерий (плазморрагии, в большинстве случаев повторные, с отеком стенок сосудов, развитием фибриноидного некроза, выраженного микрогиалиноза артерий, откладывание липидов, замещение стенок артерий соединительной тканью).
Эти изменения имеют сегментарный характер и приводят к сужению или облитерации просвета сосудов. Для их характеристики М. Фишер (1979) предложил термин «липогиалиноз», Глубокий инфаркт, который сопровождается кардиальной или артерио-артериальной эмболией, не рекомендуют называть лаку парным.
Патоморфология. По морфологии ЛИ - разновидность белого инфаркта мозга. Как уже отмечалось, при развитии ЛИ мозга формируется небольшая по размеру полость лакуна диаметром от 0,2 до 0,5-0,7 см, реже 1-1,5 см, с четкой границей. Внутри нее, а также вокруг обнаруживают очаги неполного некроза белого и серого вещества, аксональную дистрофию, валлеровскую дегенерацию волокон белого вещества, пролиферацию глиоцитов, отек. При локализации ЛИ мозга в области серого вещества наблюдаются характерные для ишемии изменения нейронов. При слиянии лакун наступает вторичное перерождение волокон белого вещества головного мозга с демиелинизацией, возникновением по их ходу зернистых шаров и изменений аксонов. Считают, что основой поражения белого вещества мозга является комплекс морфологических изменений: многочисленные лакунар-ные инфаркты, очаги неполного некроза, периваскулярный энцефалолизис с расширением периваскулярного пространства и формированием криблюр.
Локализация. ЛИ мозга в основном локализуются в глубоких отделах полушарий большого мозга, в частности, в полуовальном центре, подкорковых узлах, таламусе, внутренней капсуле, базальных отделах моста, белом веществе и ядрах мозжечка. Считают, что в 80 % случаев ЛИ мозга локализуется в белом веществе полушарий большого мозга, базальных подкорковых узлах или таламусе, и в 20 % случаев - в мозжечке и области моста.
Клиника. ЛИ мозга на начальном этапе заболевания может проявляться в форме ТИА или малого инсульта, иногда - асимптомно. Заболевание, как правило, развивается на фоне высокого системного АД. Общемозговые, менин-геальные симптомы отсутствуют, нарушения сознания не характерны. Очаговая симптоматика в большинстве случаев развивается в течение нескольких часов или суток, часто во время сна или сразу после него. Характерный признак ЛИ мозга - благоприятный исход с частичным дефицитом или полным восстановлением функций. В случае повторных аналогичных сосудистых эпизодов увеличивается размер ишемических очагов и участков демиелинизации, формируется клиническая картина сосудистой энцефалопатии.
В литературе описано свыше 25 лакунарных синдромов. В клинической практике чаще всего встречаются 4, описанные М. Фишером (1965): чисто двигательный инсульт, чисто сенсорный инсульт, атактический гемипарез, синдром дизартрии и неловкой руки. Кроме приведенных наблюдаются другие клинические синдромы: гиперкинетический, чувствительно-двигательный, изолированный центральный парез лица и др.
Чисто двигательный инсульт, или чистая моторная гемиплегия, составляет около 57-60 % всех случаев ЛИ мозга. Лакуны локализуются в задней трети задней ножки внутренней капсулы и смежных участках полуовального центра, в базальных отделах ножек мозга, области моста. У больных наблюдается полный или частичный гемипарез при отсутствии других неврологических нарушений. Прогноз в случае частичного гемипареза более благоприятен в сравнении с грубыми двигательными нарушениями. Эта группа не включает нарушения мозгового кровообращения, которые характеризуются изолированной слабостью руки или ноги. Эти случаи рассматривают как неполные инфаркты в бассейне средней или передней мозговых артерий.
Чисто сенсорный инсульт, или чистая гемианестезия, наблюдается в 20 % случаев ЛИ мозга. Синдром развивается при наличии поражения заднего вентрального ядра таламуса - основного чувствительного (сенсорного) ядра. Неврологический дефицит проявляется полным или частичным нарушением чувствительности по средней линии тела. Нарушения ее могут сопровождаться дизестезией, гиперпатией, болью. Чувствительные нарушения в основном полностью или частично регрессируют. В случае формирования лакун в области задней ножки внутренней капсулы, зрительной лучистости возникают сенсомоторные нарушения, гомонимная гемианопсия.
Атактшеский гемипарез формируется при локализации лакун в области моста или задней ножки внутренней капсулы. Частота его - около 10 % лакунарного ЛИ мозга. Неврологические нарушения - умеренная слабость преимущественно в дистальных отделах нижней конечности при минимальных проявлениях пареза верхней конечности. В клинической картине основным проявлением являются атактические нарушения в обеих конечностях (гемиатаксия).
Синдром дизартрии и неловкойруки составляет около 6 % случаев ЛИ мозга. Обусловлен локализацией лакун главным образом в базальных отделах моста, задней ножки внутренней капсулы. Неврологическая клиника - речевые нарушения типа дизартрии в сочетании с атаксией и неловкостью руки. Возможно развитие слабости в конечностях и мышцах лица. Дизартрия возникает, если поражены базальные отделы моста, чаще слева (100 %), чем справа (73 %).
Гиперкинетический синдром, или синдром «гемихорея—гемибализм», обусловлен развитием лакун в области полосатого тела, таламуса и субталами-ческого ядра, зрительной лучистости. Неврологические нарушения характеризуются гемихореей и гемибализмом, дистоническими нарушениями. Причем в случае последних расстройств лакуны локализуются в таламусе, чечевицеобразном ядре.
При наличии многочисленных ЛИ формируется псевдобульбарный синдром с дизартрией, нарушением походки - походка небольшим шагом (marche a petites pas), которую впервые описал П. Мари (1902). В результате двустороннего поражения пирамидных путей нарушается мочеиспускание (императивные позывы, периодическое недержание мочи).
В случае локализации лакун в головке хвостатого ядра возможно развитие синдрома паркинсонизма. При двусторонней капсулярной локализации ЛИ неврологические нарушения характеризуются тетрапарезом, речевыми нарушениями по типу мутизма. Формируется своеобразная семенящая походка птичья. Гомолатеральная мозжечковая симптоматика отмечается при локализации лакун в полушариях мозжечка.
ЛИ мозга большей частью проявляется неврологическим дефицитом, иногда - асимптомно («тихое» начало инсульта). Неврологическая клиника ЛИ зависит от локализации лакун. Для них характерны некоторые общие признаки, обусловленные размерами лакун, расположением их в глубоких отделах мозга, ограниченным поражением проводниковых систем: отсутствием нарушений высших мозговых функций (афазии, аграфии, агнозии, апраксии) при поражении образований левого полушария мозга; отсутствием характерной психопатологической симптоматики, апрактоагностического синдрома в случае правополушарного ЛИ; полным или значительным восстановлением утраченных функций.
Лакунарное состояние тяжелая форма поражения головного мозга, обусловленная стойкой артериальной гипертензией, распространенными деструктивными изменениями интрацеребральных артерий, многочисленными ЛИ мозга, которые главным образом являются причиной развития сосудистой деменции. Частота выявления лакунарного состояния у больных колеблется от 16 до 79 %. Считают, что снижение интеллекта у этой категории больных вызвана главным образом разрывом межполушарных связей.
Диагностика ЛИ мозга возможна с учетом особенностей развития и течения заболевания, характера неврологических нарушений, которые возникают на фоне артериальной гипертензии. Однако неврологические синдромы не всегда являются клиническим проявлением ЛИ мозга. Они могут быть обусловлены микрогеморрагиями, другими процессами несосудистого генеза (опухоли, воспалительные процессы, демиелинизация). Поэтому решающее значение для установления диагноза имеет визуализация лакун методами КТ, МРТ и диффузионно взвешенной МРТ (рис. 110). Мелкие лакуны размером до нескольких кубических миллиметров, которые вызывают развитие определенного неврологического дефицита, не всегда можно визуализировать даже с помощью рентгенорадиологических методов исследования. В случае лакунарного статуса методы КТ и МРТ в Т2-режиме позволяют обнаружить специфический феномен лейкоареозис, который характеризуется очаговой и диффузной демиелинизацией белого вещества вокруг желудочков мозга и в полуовальном центре.

МРТ головного мозга через 60 ч от начала инсульта (Т2-взвешенное изображение, аксиальная плоскость, срез на уровне глубоких отделов полушарий большого мозга): гиперинтенсивный яркий очаг (показан стрелкой) свидетельствует о лакунарном инфаркте в таламусе слева (клинически чисто сенсорный инфаркт)
 Диффузионно-взвешенная томограмма головного мозга через 60 ч от начала инсульта: а - в ДВ-изображении (аксиальная плоскость) определяется гиперинтенсивный яркий очаг в таламусе слева (показан стрелкой), что подтверждает диагноз лакунарного инфаркта; б - на карте диффузии выявлен гипоинтенсивный темный очаг инфаркта в таламусе слева (показан стрелкой) со сниженным коэффициентом диффузии
Диффузионно-взвешенная томограмма головного мозга через 60 ч от начала инсульта: а - в ДВ-изображении (аксиальная плоскость) определяется гиперинтенсивный яркий очаг в таламусе слева (показан стрелкой), что подтверждает диагноз лакунарного инфаркта; б - на карте диффузии выявлен гипоинтенсивный темный очаг инфаркта в таламусе слева (показан стрелкой) со сниженным коэффициентом диффузии
Гемодинамический инсульт. Кроме тромбоза и эмболии, в развитии ишемического инсульта значительное место принадлежит гемодинамическим механизмам, в частности сосудистой мозговой недостаточности, срыву реакции ауторегуляции мозгового кровообращения, ангиодистоническим нарушениям в сосудах мозга (вазопарез, стаз).Гемодинамический инфаркт, который возникает при наличии патологии экстра и/или интракраниальных артерий в результате сосудистой мозговой недостаточности, обычно развивается на поверхностной части мозга, в корковом слое. Чаще это происходит в областях соединения периферических ветвей средней мозговой артерии с участками кровоснабжения передней и задней мозговых артерий (зоны смежного кровообращения; рис. 111). Иначе говоря, это инфаркт, который развивается «в пограничных зонах» по принципу «последнего луга» (К. Цюльх, 1955). Размеры инфаркта могут быть разными от мелких очагов до больших; последние охватывают корково-подкорково-капсулярный участок мозга (территориальный инфаркт).
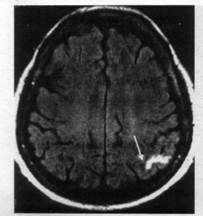
МРТ головного мозга больного с малым кортикальным инфарктом левой теменной доли через 23 ч от начала заболевания (Т2ТИРМ-взвешенное изображение, аксиальная плоскость, срез на уровне глубоких отделов полушарий большого мозга): в левой теменной доле визуализируется неправильной формы гиперинтенсивный очаг инфаркта однородной структуры с четкими контурами (показано стрелкой)
Гемодинамический инфаркт может возникать и в результате снижения АД, уменьшения сердечного выброса, в результате ишемии миокарда, развития церебральных синдромов обкрадывания.
Гемореологичестй инсульт. В возникновении гемореологического инсульта (гемореологической окклюзии) имеют значение изменения физико-химических свойств крови, увеличение ее коагуляции в мозговом кровотоке. Повышение вязкости цельной крови является одним из механизмов тромбообразования при наличии вазопаретических нарушений.
Среди механизмов развития гемореологического инсульта значительную роль играет микроэмболия, которая образуется конгломератами клеточных элементов крови - эритроцитов и тромбоцитов. Характеризуется постепенным развитием очаговых симптомов в течение нескольких часов или 2-3 сут. Поскольку тромбоцитарные эмболы достаточно хрупкие, они легко поддаются дезагрегации, распаду или лизису, который обусловливает обратное развитие неврологического дефицита (полное или частичное) в течение от 2 до 21 сут, вариант малого ишемического инсульта. Относительно легкое течение заболевания объясняется небольшими размерами очагов ишемии (1 х 2,5 см).
Гемореологический подтип ишемического инсульта определяется при отсутствии системной сосудистой (атеросклероз, артериальная гипертен-зия, болезни сердца), а также гематологической (полицитемия, тромбоци-тоз, коагулопатии, антифосфолипидный синдром) патологии.
Диагностика ишемического инсульта основывается на внимательном изучении прединсультного периода, анализе темпа его развития и динамики заболевания. Важно определить, есть ли у больного артериальная гипертен-зия, проявления ИБС (нарушение ритма сердца и проводимости, признака недостаточности кровообращения), уточнить анамнез (перенесенные инфаркт миокарда, инсульт, ТИА), обнаружить возможные факторы риска (сахарный диабет, интоксикация никотином, злоупотребление алкогольными напитками, избыточная масса тела, наследственная склонность), внимательно исследовать пульсацию периферических и магистральных сосудов головы и шеи. Полученные данные в сочетании с клинической неврологической симптоматикой, результатами исследования глазного дна, реологических свойств крови, спинномозговой жидкости, эхо- и электроэнцефалографии, ультразвуковой допплерографии, электрокардиографии, а также с помощью рентгенологических методов (краниографии, ангиографии, КТ) дают возможность установить диагноз ишемического инсульта и дифференцировать его с другими заболеваниями, которые имеют подобное клиническое течение.
Необходимо также помнить о возможных атипичных вариантах течения ишемического инсульта (геморрагический инфаркт, зеркальный и опухоле-подобный инсульт, а также псевдоинсульт).
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 852; Нарушение авторских прав?; Мы поможем в написании вашей работы!