
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модели строения атома
|
|
|
|
Электронное строение атома
Лекция 1
Антропологизм — учение о человеке, человек это существо, которое, оперируя понятиями и ценностями, вырабатывает на их основе жизненные установки и осуществляет их.
Прагматическая вера - как подлинное основание действия и несколько методов. Это «метод упорства» в достижении цели, «метод авторитета», требующий согласовать личные цели с «общим мнением», «априорный метод», по которому необходимо действовать согласно установкам общей разумности интеллекта, и «научный метод», утверждающий возможность объективного познания. Термин «прагматизм» был введен Пирсом и означает «философию действия».
Самопознание - это экономное приспособление мысли к фактам.
Фальсифицируемость - это демаркационный критерий науки и метафизики.
Экзистенциализм -философское течение, считающее своим предметом человеческую жизнь, человеческое существование.
Аксеология — учение о ценностях.
Я очень Вам советую прочитать книгу Митчелла Уилсона «Живи с молнией» (Live with Lightning). Она посвящена заявленной теме и зарядит Вас энергией достижения, приоткроет интригующую завесу мира исследователей. Повествуется в ней об исследованиях физиков первой половины двадцатого столетия.
В первой атомной теории Дальтона предполагалось, что мир состоит из определенного числа атомов — элементарных кирпичиков — с характерными свойствами, вечными и неизменными.
К концу XIX века были накоплены сведения, подтверждающие сложное строение атома. Все атомы должны содержать электроны. Но как электроны в них расположены? Физики могли лишь философствовать, исходя из своих познаний в области классической физики, в тот период был выдвинут целый ряд моделей строения атома и постепенно все точки зрения сошлись на одной модели, предложенной Дж.Дж. Томсоном в 1903 году. Согласно этой модели, атом состоит из положительно заряженного вещества, внутрь которого вкраплены электроны (возможно, они находятся в интенсивном движении), так что атом напоминает пудинг с изюмом. Томсоновскую модель атома нельзя было непосредственно проверить, но в ее пользу свидетельствовали всевозможные аналогии.
В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на протяжении нескольких лет совместно с Содди занимался вопросами радиоактивности. И уже будучи профессором Макгиллского университета в Монреале предложил своим студентам Эрнесту Марсдену и Хансу Гейгеру выяснить, могут ли альфы-частицы отражаться от золотой фольги. Резерфорд был абсолютно убежден в том, что массивные альфа-частицы должны испытывать лишь незначительные отклонения, проходя сквозь золотую фольгу. Большинство из них действительно проходило сквозь фольгу, лишь слабо отклоняясь. Но некоторые альфа-частицы — примерно одна из 20 000, — как заметил Марсден, — отклонялись на углы больше 90 градусов. Марсден даже побоялся рассказать об этом Резерфорду и тщательно удостоверился сначала в том, что в его опытах не было ошибки. Резерфорд почти не поверил в этот результат наблюдений. Много лет спустя Резерфорд вспоминал: «Это было, пожалуй, самым невероятным событием, которое я когда-либо переживал в своей жизни. Это было столь же неправдоподобно, как если бы Вы произвели выстрел по обрывку папиросной бумаги 15-дюймовым снарядом, а он вернулся бы назад и угодил в вас».
Но в неправдоподобное пришлось поверить, и в 1911 году Резерфорд пришел к убеждению, что результаты опытов по рассеянию альфа-частиц золотой фольгой можно объяснить, только предположив, что альфа-частицы проходят на весьма малом расстоянии от других положительно заряженных частиц с размерами, много меньшими размеров атомов. Атом золота должен состоять из малого положительного заряженного ядра и окружающих его электронов. Это наблюдение заставило Резерфорда выдвинуть новую модель атома, согласно которой положительно заряженное ядро окружено электронами. Это было рождением не только идеи об атомном ядре, но и новой отрасли физики — ядерной физики. Физики всего мира могли теперь оценить еще одну, на сей раз убедительно подтвержденную экспериментально, модель строения атома (рис.1)...
Рис. 1. Модели атома: а) Томсона ("сливовый пудинг"), б) Резерфорда ("электронный рой" в пространстве вокруг ядра), в) планетарная модель Бора

Хочу Вам сказать, что Резерфорд был неутомим. И тут же предпринял новое исследование: стал определять количество альфа-частиц, отклоненных фольгой на различные углы в зависимости от электрического заряда ядер атомов того вещества, из которого сделана фольга. Терпение исследователей было вознаграждено. Анализируя результаты этих опытов, Резерфорд вывел формулу, связывающую число альфа-частиц, отклоненных на определенный угол, с зарядом ядер вещества фольги-мишени. Теперь можно было из опытов по рассеянию альфа-частиц определять природу материала мишени. В руках исследователей появился первый ядерный метод химического анализа! Ученые сравнили между собой поведение мишеней из различных материалов и установили, что чем больше заряд ядра, тем сильнее отклоняются альфа-частицы от прямолинейного пути. И здесь впервые физические эксперименты приоткрыли завесу тайны над периодическим законом элементов.
Рассчитанный на основе данных проведенного эксперимента размер ядра атома оказался примерно в 100 000 раз меньше размера самого атома. После этого в 1920 году Резерфорд предсказал существование протона и показал, что его масса более чем в 1800 раз должна превышать массу электрона. Экспериментально нейтрон был обнаружен в 1932 г.
И все эти годы физиков мира не покидала мысль о том, что же удерживает электрон от падения на массивное ядро? Конечно, быстрое вращение вокруг него. Но в процессе вращения с ускорением в поле ядра электрон должен часть своей энергии излучать во все стороны и, постепенно тормозясь, все же упасть на ядро. Эта мысль не давала покоя авторам планетарной модели атома. Очередное препятствие на пути новой физической модели, казалось, должно было разрушить всю с таким трудом построенную и доказанную четкими опытами картину атомной структуры... Резерфорд был уверен, что решение найдется, но он не мог предполагать, что это произойдет так скоро.
Водород в так называемой водородной лампе разогревается сильным электрическим разрядом. Испускаемый атомами водорода свет, пройдя через призму, дает спектр, состоящий из отдельных линий. На рисунке показана только видимая область спектра. Позже, с совершенствованием спектрометров, были открыты серии линий в ультрафиолетовой и в инфракрасной области. Датский физик Нильс Бор разрабатывал модель атома водорода, рассуждая: «Если у водорода только один электрон, каким образом можно объяснить тот факт, что он излучает несколько различных по длине волны световых лучей?».
Предполагалось, что свет возникает в результате колебаний групп атомов и частота этих колебаний как-то связана с частотой волны испускаемого света.
К счастью, существовало еще одно досадное затруднение классической физики, разрешение которого неожиданно помогло продвинуться в понимании строения атома. Классическая физика не могла объяснить, почему при нагревании физическое тело начинает светиться не синим или фиолетовым, а красным светом. С помощью излучения нагретое физическое тело избавляется от излишка энергии. Но наиболее эффективная, быстрая отдача энергии должна происходить с помощью коротковолновых световых волн, способных нести много энергии! В этом случае нагреваемый в горне кусок железа должен выглядеть фиолетовым или синим, но не красным! Наше Солнце – огромное, нагретое до высоких температур физическое тело, должно заливать Землю фиолетовым (и даже еще более коротковолновым) излучением. Разумеется, это резко противоречит тому, что мы наблюдаем.
Непрерывное волновое излучение нагретого тела действительно должно было бы иметь малую (фиолетовую) длину волны, в то время как излучение того же количества энергии как бы "зарядом картечи" из мелких порций энергии должно состоять (чисто статистически) из волн разной энергии, среди которых фиолетовые не обязательно в большинстве.
Можно привести такую аналогию. В некоем городе наступила небывалая жара, и все люди на различных видах транспорта устремились за город, на природу. Наиболее быстро все могли бы выехать на легковых машинах, которые развивают наибольшую скорость. Но кто-то едет на автобусе, кто-то на велосипеде, кто-то на электричке. Если построить график в координатах: "число машин" – "скорость машин", то выяснится, что очень быстроходных и очень тихоходных машин довольно мало, а основная масса людей передвигается за город не очень быстро, но и не очень медленно (рис. 2).
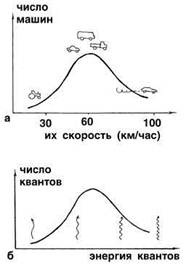
Рис. 2. а) График распределения машин в городе по скорости их движения: "лихачей" и "тихоходов" относительно мало, а основная масса водителей соблюдает обычный скоростной режим. б) Аналогичный график для квантов света, рождаемых "быстрыми" и "медленными" атомами по гипотезе Планка.
Сам Планк в 1900 году скромно называл свою гипотезу "математическим приемом" и "рабочим предположением". Он не скрывал, что был вынужден выдвинуть такую "странную" формальную гипотезу ради одного – чтобы любой ценой получился положительный результат. Это было нелегко сделать теоретику-классику, воспитанному на принципе "природа не делает скачков", в докторской диссертации которого за 20 лет до описываемых событий развивалась мысль о том, что атомистические взгляды на строение материи приводят к противоречиям.
В итоге в1912 году на квантовую гипотезу обратил внимание датский физик Нильс Бор, который применил ее к модели атома Резерфорда и получил поразительные результаты в объяснении атомных спектров испускания водорода. Бор предположил, что электронный "рой" в модели Резерфорда не беспорядочен. Электроны в нем располагаются на строго определенных, постоянных орбитах.
В модели Резерфорда электроны тоже двигались по орбитам, но эти орбиты могли быть "спиралевидными". Двигаясь по спирали ближе или дальше к ядру, атом мог излучать или поглощать энергию. В этом случае спектры испускания атомов должны были быть похожими на непрерывный солнечный спектр, а спектр испускания водорода оказался прерывистым, линейчатым.
Бор предложил считать аксиомой тот факт, что только на постоянных, стационарных орбитах электрон может существовать устойчиво, не падая на ядро. Объяснение этого феномена Бор откладывал до лучших времен, предлагая посмотреть, как новая модель объясняет экспериментальные факты. Постулаты Бора можно сформулировать следующим образом:
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 866; Нарушение авторских прав?; Мы поможем в написании вашей работы!