
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионный обмен
|
|
|
|
Методы разделения и концентрирования
Общие сведения о разделении и концентрировании
Разделение – это операция, позволяющая отделить компоненты пробы друг от друга.
Его используют, если одни компоненты пробы мешают определению или обнаружению других, т. е. когда метод анализа недостаточно селективен и надо избежать наложения аналитических сигналов. При этом обычно концентрации разделяемых веществ близки.
Концентрирование – это операция, позволяющая увеличить концентрацию микрокомпонента относительно основных компонентов пробы (матрицы).
Его используют, если концентрация микрокомпонента меньше предела обнаружения С min, т. е. когда метод анализа недостаточно чувствителен. При этом концентрации компонентов сильно различаются. Часто концентрирование совмещается с разделением.
Виды концентрирования.
1. Абсолютное: микрокомпонент переводят из большого объёма или большой массы пробы (V пр или m пр) в меньший объём или меньшую массу концентрата (V конц или m конц). В результате концентрация микрокомпонента увеличивается в n раз:

где n – степень концентрирования.
Чем меньше объём концентрата, тем больше степень концентрирования. Например, 50 мг катионита поглотили германий из 20 л водопроводной воды, затем германий десорбировали 5 мл кислоты. Следовательно, степень концентрирования германия составила:
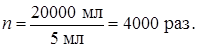
2. Относительное (обогащение): микрокомпонент отделяется от макрокомпонента так, что отношение их концентраций увеличивается. Например, в исходной пробе отношение концентраций микро- и макрокомпонентов составляло 1: 1000, а после обогащения – 1: 10. Обычно это достигается путём частичного удаления матрицы.
Разделение и концентрирование имеют много общего, для этих целей используются одни и те же методы. Они очень разнообразны. Далее будут рассмотрены методы разделения и концентрирования, имеющие наибольшее значение в аналитической химии.
Классификация методов разделения и концентрирования
Существует множество классификаций методов разделения и концентрирования, основанных на разных признаках. Рассмотрим важнейшие из них.
1. Классификация по природе процесса дана на рис.62.

Рис. 62.Классификация методов разделения по природе процесса
Химические методы разделения и концентрирования основаны на протекании химической реакции, которая сопровождается осаждением продукта, выделением газа. Например, в органическом анализе основным методом концентрирования является отгонка: при термическом разложении матрица отгоняется в виде СО2, Н2О, N2, а в оставшейся золе можно определять металлы.
Физико-химические методы разделения и концентрирования чаще всего основаны на избирательном распределении вещества между двумя фазами. Например, в нефтехимической промышленности наибольшее значение имеет хроматография.
Физические методы разделения и концентрирования чаще всего основаны на изменении агрегатного состояния вещества.
2. Классификация по физической природе двух фаз. Распределение вещества может осуществляться между фазами, которые находятся в одинаковом или разном агрегатном состоянии: газообразном (Г), жидком (Ж), твёрдом (Т). В соответствии с этим различают следующие методы (рис.63).

Рис. 63. Классификация методов разделения по природе фаз
В аналитической химии наибольшее значение нашли методы разделения и концентрирования, которые основаны на распределении вещества между жидкой и твёрдой фазой.
3. Классификация по количеству элементарных актов (ступеней).
§ Одноступенчатые методы – основаны на однократном распределении вещества между двумя фазами. Разделение проходит в статических условиях.
§ Многоступенчатые методы – основаны на многократном распределении вещества между двумя фазами. Различают две группы многоступенчатых методов:
– с повторением процесса однократного распределения (например, повторная экстракция). Разделение проходит в статических условиях;
– методы, основанные на движении одной фазы относительно другой (например, хроматография). Разделение проходит в динамических условиях
3. Классификация по виду равновесия (рис.64).

Рис. 64. Классификация методов разделения по виду равновесия
Термодинамические методы разделения основаны на различии в поведении веществ в равновесном состоянии. Они имеют наибольшее значение в аналитической химии.
Кинетические методы разделения основаны на различии в поведении веществ во время процесса, ведущего к равновесному состоянию. Например, в биохимических исследованиях наибольшее значение имеет электрофорез. Остальные кинетические методы используются для разделения частиц коллоидных растворов и растворов высокомолекулярных соединений. В аналитической химии эти методы применяются реже.
Хроматографические методы основаны и на термодинамическом, и на кинетическом равновесии. Они имеют огромное значение в аналитической химии, поскольку позволяют провести разделение и одновременно качественный и количественный анализ многокомпонентных смесей.
Экстракция как метод разделения и концентрирования
Экстракция – это метод разделения и концентрирования, основанный на распределении вещества между двумя несмешивающимися жидкими фазами (чаще всего – водной и органической).
С целью экстракционного разделения создают такие условия, чтобы один компонент полностью перешёл в органическую фазу, а другой – остался в водной. Затем делят фазы с помощью делительной воронки.
С целью абсолютного концентрирования вещество переводят из большего объёма водного раствора в меньший объём органической фазы, в результате чего концентрация вещества в органическом экстракте увеличивается.
С целью относительного концентрирования создают такие условия, чтобы микрокомпонент перешёл в органическую фазу, а бóльшая часть макрокомпонента осталась бы в водной. В результате в органическом экстракте отношение концентраций микро- и макрокомпонента увеличивается в пользу микрокомпонента.
Достоинства экстракции:
§ высокая избирательность;
§ простота выполнения (нужна только делительная воронка);
§ малая трудоёмкость;
§ быстрота (3–5 мин);
§ экстракция очень хорошо сочетается с методами последующего определения, в результате чего возник ряд важных гибридных методов (экстракционно-фотометрический, экстракционно-спект-ральный и др.).
Соосаждение как метод разделения и концентрирования
Соосаждение – это захват микрокомпонента осадком-коллектором во время его образования, причём микрокомпонент переходит в осадок из ненасыщенного раствора (ПС < ПР).
В качестве коллекторов используют неорганические и органические малорастворимые соединения с развитой поверхностью. Разделение фаз проводят путём фильтрования.
Соосаждение применяют с целью:
§ концентрирования примесей как очень эффективного и одного из наиболее важных методов, который позволяет повысить концентрацию в 10–20 тыс. раз;
§ отделения примесей (реже).
Сорбция как метод разделения и концентрирования
Сорбция – это поглощение газов или растворённых веществ твёрдыми или жидкими сорбентами.
В качестве сорбентов используют активные угли, Al2O3, кремнезём, цеолиты, целлюлозу, природные и синтетические сорбенты с ионогенными и хелатообразующими группами.
Поглощение веществ может происходить на поверхности фазы (а д сорбция) или в объёме фазы (а б сорбция). В аналитической химии чаще всего применяют адсорбцию с целью:
§ разделения веществ, если создать условия для селективного поглощения;
§ концентрирования (реже).
Кроме того, сорбция в динамических условиях положена в основу важнейшего метода разделения и анализа – хроматографии.
Ионный обмен – это обратимыйстехиометрический процесс, который происходит на границе раздела фаз ионит – раствор электро
лита.
Иониты – это высокомолекулярныеполиэлектролиты различного строения и состава.
Основным свойством ионитов является то, что они поглощают из раствора катионы или анионы, выделяя при этом в раствор эквивалентное число ионов того же знака заряда.
Процесс ионного обмена описывается законом действия масс:
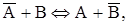
где А и В – ионы в растворе,  и
и  – ионы в фазе ионита.
– ионы в фазе ионита.
Это равновесие характеризуется константой обмена (К):

где а – активности ионов.
Если К > 1, то ион В обладает бóльшим сродством к иониту; если К < 1, то ион А обладает бóльшим сродством к иониту; если же К ≈ 1, то оба иона одинаково сорбируются ионитом.
На протекание ионного обмена влияют следующие факторы:
1) природа ионита;
2) природа иона: чем больше отношение заряда иона к радиусу гидратированного иона (z/r), тем больше сродство к иониту;
3) свойства раствора:
§ значение рН (см. в следующих разделах);
§ концентрация иона: из разбавленных растворов ионит сорбирует ионы с бóльшим зарядом, а из концентрированных – с меньшим;
§ ионная сила раствора: чем меньше μ, тем лучше сорбируются ионы.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 541; Нарушение авторских прав?; Мы поможем в написании вашей работы!