
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительное титрование
|
|
|
|
(оксредметрия, редоксиметрия)
.
В основе метода – ОВР. В качестве титрантов – растворы веществ, обладающие окислительными или восстановительными свойствами.
Сродством к электрону называют количество энергии, выделяющейся (или поглощающейся) при присоединении электрона к нейтральному атому с превращением его в отрицательный ион. Сродство к электрону является мерой окислительной способности атомов: чем больше сродство элемента к электрону, тем он более сильный окислитель.
Энергией ионизации называют количество энергии, необходимое, для отрыва электрона от невозбужденного атома. Энергия ионизации может служить мерой восстановительных свойств: чем меньше энергия ионизации атома, тем он более энергичный восстановитель.
При сопоставлении окислительно-восстановительных свойств элементов часто пользуются понятием электроотрицательности. Электроотрицательностью называют полусумму энергии ионизации и сродства к электрону, выраженную в кДж/г-атом.
Например: в реакции взаимодействия серы с кислородом
S+O2 = SO2
Кислород - окислитель, сера - восстановитель.
Количественной мерой окислительной способности редокс-системы служат ОВ потенциалы.
Уравнением Нернста

φ0 – стандартный электродный потенциал данного процесса (константа)
R – универсальная газовая постоянная 8,31 Дж/(моль*К)
Т – абсолютная температура, К
F – постоянная Фарадея, 96500 Кл/моль
[Ox] и [Red] – произведения концентраций веществ, участвующих в реакции в окисленной (Ох) и восстановленной (Red) формах.
Если концентрации (активности) веществ, участвующих в электродном процессе равны 1, тогда (lg1=0), следовательно, уравнение принимает вид
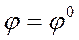
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!