
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формулы для расчета
|
|
|
|
Способы выражения концентрации растворов
РАСЧЕТЫ В ОБЪЕМНОМ МЕТОДЕ АНАЛИЗА
Концентрация – количественная характеристика раствора. Величина, характеризующая число частиц, отнесенное к единице объема.
Молярная концентрация – число молей растворенного вещества в 1 дм3 раствора.
Например, раствор, содержащий 49 г серной кислоты в 1 дм3, имеет концентрацию 0,5 М (моль/дм3), т.к. молярная концентрация этой кислоты 98 г/моль.
Моляльность – количество молей в 1000 г растворителя. (моль/кг)
Массовая и молярная доли. Используются для различных практических расчетов в химии
Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Выражается в доля единицы.
Молярная доля – отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор.
х=ni / Σni
Нормальность. Под нормальностью раствора понимают число эквивалентов вещества растворенного в 1 дм3 раствора.
(1,0 н нормальный, 0,1 - децинормальный, 0,01 – сантинормальный раствор.)
Процентная концентрация (массовые проценты) – число массовых частей растворенного вещества в 100 массовых частях раствора.
1. Закон эквивалентов
V1N1=V2N2
2. Определение титра раствора
ТА=NA*ЭА/1000
например, вычислить титр раствора соляной кислоты, если его нормальность NHCl=0,09865
ТHCl=N*ЭHCl/1000=0,09865*36,46/1000=0,003597 г/мл
3. Определение титра по определяемому компоненту
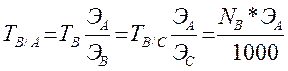
При выражении концентрации титрованных растворов через нормальность часто пользуются коэффициентом нормальности (К) или поправочным коэффициентом (поправкой). Коэффициент нормальности показывает, во сколько раз нормальность данного раствора больше или меньше теоретической нормальности того же раствора. Его вычисляют следующим образом
К=Спр/Срасч = Тпр/Трасч.
Делением нормальности титрованного раствора на точно заданную нормальность. Если нормальность 0,1н равна 0,09736, то К=0,09736/0,1=0,9736.
Расчет концентрации определяемого элемента по Титру стандартного раствора по определяемому компоненту
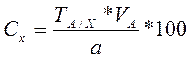 (%)
(%) 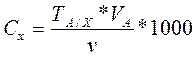 (г/дм3)
(г/дм3)
где а – навеска анализируемого вещества, г
v – объем аликвоты раствора, см3
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!