
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Трансаминирование
|
|
|
|
Роль трансдезаминирования
· Сопряженные реакции трансаминирования и дезаминирования создают поток лишнего азота из периферических клеток в печень.
· Реакции трансаминирования обеспечивают синтез аминокислот при наличии их углеродного скелета (кетоаналога).
· Обратимость процессов позволяет клетке использовать при необходимости свободный аммиак.
Ниже подробно разбираются реакции трансаминирования и дезаминирования.
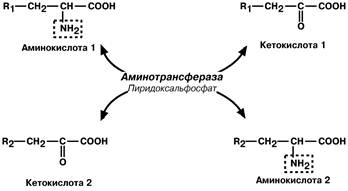 |
Сначала происходит обратимая реакция – перенос NH2‑группы с аминокислоты на другую кетокислоту (трансаминирование). Последняя при этом превращается в аминокислоту.
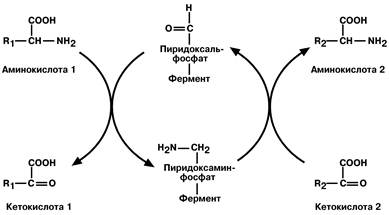 |
Механизм реакции трансаминирования достаточно сложен и протекает по принципу пинг‑понг. Аминотрансферазы являются сложными ферментами, в качестве кофермента они имеют пиридоксальфосфат (активная форма витамина В6). Сначала к нему присоединяется аминокислота, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. После этого присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и регенерирует пиридоксальфосфат.
 |
Роль пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин, кетимин).
Трансаминирование активируется:
· при поступлении в клетку избыточного количества аминокислот;
· при прекращении использования аминокислот на синтез азотсодержащих соединений: белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований;
· при гипогликемиях различного генеза, сахарном диабете, т.е. при внутриклеточном голодании.
В результате аминокислоты теряют NH2‑группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот, где сгорает до СО2 и Н2О.
В тканях насчитывают около 10 аминотрансфераз, которые обладают групповой специфичностью и вовлекают в реакции все аминокислоты, кроме пролина, лизина, треонина.
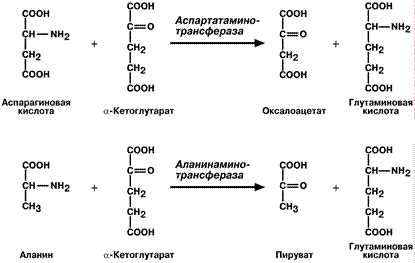 Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной (с образованием аланина), щавелевоуксусной (с образованием аспартата), a‑кетоглутаровой (с образованием глутамата). Однако аланин и аспартат в дальнейшем передают свою аминогруппу на a‑кетоглутаровую кислоту.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной (с образованием аланина), щавелевоуксусной (с образованием аспартата), a‑кетоглутаровой (с образованием глутамата). Однако аланин и аспартат в дальнейшем передают свою аминогруппу на a‑кетоглутаровую кислоту.
Таким образом, в тканях осуществляется поток избыточных аминогрупп на один акцептор – a‑кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
В медицине нашло практическое применение определение активности двух аминотрансфераз – аланинаминотрансферазы (АЛТ) и аспартатаминтрансферазы (АСТ).
Определение активности АЛТ и АСТ имеет исключительное значение для диагностики и дифференциальной диагностики болезней печени и миокарда и контроля эффективности лечения.
Повышение активности АСТ наблюдается и при таких формах инфаркта миокарда, которые не диагностируются с помощью ЭКГ. Повышение активности фермента в 2‑20 раз отмечается в 95% случаев инфаркта миокарда. 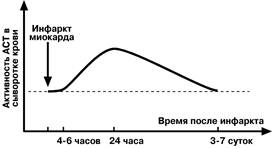
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2607; Нарушение авторских прав?; Мы поможем в написании вашей работы!