
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические и химические свойства. Марганец, технеций, рений – серебристо-белые, твердые, тугоплавкие металлы
|
|
|
|
Марганец, технеций, рений – серебристо-белые, твердые, тугоплавкие металлы. При переходе от марганца к рению увеличивается устойчивость соединений с высшей степенью окисления элементов и усиливается тенденция к образованию кислотных оксидов и кислот. Марганец сохраняет устойчивость при нагревании на воздухе благодаря образованию защитной пленки 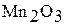 . При нагревании технеция и рения в присутствии кислорода образуются оксиды
. При нагревании технеция и рения в присутствии кислорода образуются оксиды 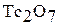 и
и  , которые не защищают металл от дальнейшего окисления.
, которые не защищают металл от дальнейшего окисления.
Марганец при нагревании разлагает воду, вытесняя водород; образующийся при этом гидроксид марганца (II) замедляет реакцию разложения воды. Марганец и рений поглощают водород. При 1200 °С марганец и рений взаимодействуют с азотом, образуют различные по составу нитриды. Марганец взаимодействует с кремнием, бором, фосфором, образуя силициды, бориды, фосфиды. Марганец взаимодействует с кислотами с образованием соответствующих солей:
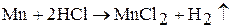
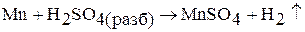

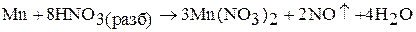

В табл. 2 приведены кислородные соединения марганца, рения и технеция. Оксиды марганца получают термическим разложением оксидов, солей:


Оксид марганца (II) МnО с водой не взаимодействует, но легко реагирует с кислотами:
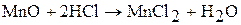
Гидроксид Мn(ОН)2 (белого цвета) получают косвенным путем – действием щелочи на раствор соли марганца (II):
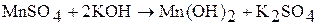
При действии окислителей производные Мn (II) проявляют восстановительные свойства. Например, на воздухе Мn(ОН)2 окисляется, превращаясь в гидроксид марганца (IV) бурого цвета:


Таблица 2
Кислородные соединения элементов VII группы побочной подгруппы
| Название | Степень окисления | Оксиды | Гидроксиды | Соли | |||
| Формула | Характер | Формула | Название | Формула иона | Название | ||
| Mn | +2 | MnO | основный | Mn(OH)2 | Гидроксид марганца (II) | Mn2+ | Соли марганца (II) |
| +3 | 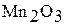
| основной | 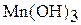
| Гидроксид марганца (III) | 
| Соли марганца (III) | |
| +4 | 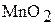
| амфотерный | 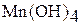
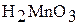
| Гидроксид марганца (III) Оксоманганат (IV) водорода или марганцеватистая кислота | 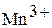

| Соли марганца (III) Оксоманганат (IV) или манганиты | |
| +6 | 
| кислотный | 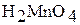
| Оксоманганат (VI) водорода или марганцовистая кислота | 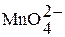
| Оксоманганат (VI) или манганаты | |
| +7 | 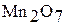
| кислотный | 
| Оксоманганат (VII) водорода или марганцовая кислота | 
| Оксоманганат (VII) или перманганаты | |
| Re | +6 | 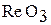
| кислотный | 
| Оксоренат (VI) водорода | 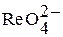
| Оксоренаты (VI) |
| +7 | 
| кислотный | 
| Тетраоксоренат (VII) водорода или рениевая кислота | 
| Оксоренаты (VII) или перренаты | |
| Tc | +7 | 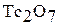
| кислотный | 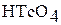
| Тетраоксотехнат (VII) водорода или технециевая кислота | 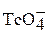
| Пертехнаты |
Сильные окислители переводят соединения Мn (II) в оксоманганаты (VII). Например:

Оксид марганца (IV) 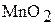 амфотерен и при высоких температурах взаимодействует с основными оксидами с образованием оксоманганатов (манганитов):
амфотерен и при высоких температурах взаимодействует с основными оксидами с образованием оксоманганатов (манганитов):
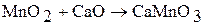
Соединения Мn (IV) – сильные окислители:

 В
В
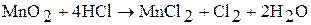
В качестве окислителя оксид марганца (IV) широко используется в технике и лабораторной практике, а также в стекольной промышленности (обесцвечивание стекла) и спичечном производстве.
Оксидам Мn (VI) и Мn (VII) соответствуют нестойкие кислоты 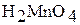 и
и  , которые мгновенно разлагаются:
, которые мгновенно разлагаются:
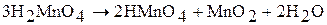

Соли марганцовистой кислоты 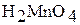 – манганаты (VI) – получают сплавлением
– манганаты (VI) – получают сплавлением 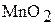 со щелочью в присутствии окислителя:
со щелочью в присутствии окислителя:
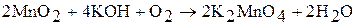
Манганаты (VI) – соединения ярко-зеленого цвета, устойчивы в щелочной среде, в нейтральных и кислых растворах они диспропорционируют:
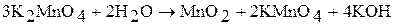
Соединения Mn(VI) – сильные окислители, особенно в кислой среде:

 В
В
При действии сильных окислителей манганаты (VI) превращаются в перманганаты:

Марганцовая кислота  является сильной кислотой, но существует только в водных растворах (в свободном состоянии она не выделена). Растворы перманганатов окрашены в малиново-фиолетовый цвет (цвет перманганат-иона
является сильной кислотой, но существует только в водных растворах (в свободном состоянии она не выделена). Растворы перманганатов окрашены в малиново-фиолетовый цвет (цвет перманганат-иона  ).
).
При прокаливании в сухом виде перманганаты уже при температуре 200 °С разлагаются с образованием манганата, оксида марганца (IV) и кислорода:

В лабораторных условиях ранением перманганата калия получают кислород.
При действии концентрированной серной кислоты на перманганат калия образуется марганцовый ангидрид 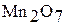 :
:

Марганцовый ангидрид 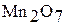 – тяжелая маслообразная жидкость зеленовато-бурого цвета. Оксид
– тяжелая маслообразная жидкость зеленовато-бурого цвета. Оксид 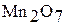 очень неустойчив и при нагревании разлагается со взрывом:
очень неустойчив и при нагревании разлагается со взрывом:

При взаимодействии 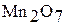 с водой образуется марганцовая кислота
с водой образуется марганцовая кислота  :
:

Так как марганец в своих соединениях имеет разную степень окисления (от +2 до +7), то те соединения или ионы, в которых марганец имеет низшую степень окисления, будут восстановителями, т.е. сами будут окисляться.
Соединения или ионы с промежуточной степенью окисления +4 (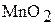 ,
,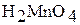 ) и +6
) и +6 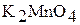 будут или восстановителями, или окислителями – все зависит от условий протекания реакции и веществ, с которыми они взаимодействуют. Например:
будут или восстановителями, или окислителями – все зависит от условий протекания реакции и веществ, с которыми они взаимодействуют. Например:
1. 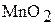 – восстановитель:
– восстановитель:

2. 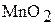 – окислитель:
– окислитель:
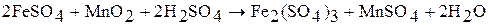
3. 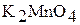 – восстановитель:
– восстановитель:
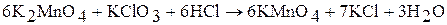
4. 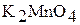 – окислитель:
– окислитель:

Соединения марганца (VII) – окислители. Перманганат калия – сильнейший окислитель; в зависимости от рН его окислительные свойства изменяются и из одинаковых исходных веществ образуются различные продукты его восстановления.
Оксиды 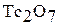 и
и  – устойчивые соединения желтого цвета, их получают непосредственным окислением простых веществ; при растворении.
– устойчивые соединения желтого цвета, их получают непосредственным окислением простых веществ; при растворении.
В ряду кислот НМnO4 – HTcO4 – HReO4 сила кислот и их окислительная активность уменьшается. Ионы этих кислот окрашены:  – фиолетовый,
– фиолетовый, 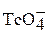 – розовый,
– розовый, 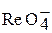 – бесцветный.
– бесцветный.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2302; Нарушение авторских прав?; Мы поможем в написании вашей работы!