
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения хлора с положительной степенью окисления
|
|
|
|
| Свойство | HClO | HClO2 | HClO3 | HClO4 |
| Степень окисления | +1 | +3 | +5 | +7 |
| Название | хлорноватистая (гипохлориты) | хлористая (хлориты) | хлорноватая (хлораты) | хлорная (перхлораты) |
| Константа диссоциации | 3,2 × 10–8 | 1,1 × 10–2 | 101 | 1010 |
| Кратность связи Cl-O | 1,5 | 1,67 | 1,75 |
С увеличением степени окисления и с увеличением кратности связи происходит ослабление связи О – Н за счет смещения электронной плотности по кратной связи Cl – O, увеличивается подвижность Н+, следовательно, с увеличением степени окисления сила кислот увеличивается.
Какая из кислот является наиболее устойчивой? С увеличением кратности связи Cl – O увеличивается устойчивость аниона, а как следствие этого падает его реакционная способность.
Соединения хлора с положительной степенью окисления проявляют окислительные свойства (стремятся перейти в Cl–).
Хотя с увеличением степени окисления должны усиливаться окислительные свойства, но решающее значение здесь имеет устойчивость аниона, которая увеличивается. В ряду HClO – HClO4 окислительная активность уменьшается. Максимум окислительных свойств приходится на хлористую кислоту HClO2.
| HClO | HClO2 | HClO3 | HClO4 | |
Стандартный электродный потенциал 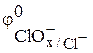 , В , В
| +1,50 | +1,54 | +1,45 | +1,38 |
Хлорноватистая кислота HClO в свободном состоянии неустойчива, быстро разлагается на ClO2 и Н2О, поэтому существует только в разбавленных водных растворах. Получают путем взаимодействия газообразного хлора с оксидом ртути (II):
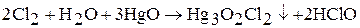
Хлорноватистая кислота – слабая кислота. Раствор хлорноватистой кислоты и гипохлоритов имеют желто-зеленую окраску, резкий запах. В водном растворе HClO диспропорционирует:

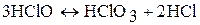 (при нагревании)
(при нагревании)
В растворе под действием света HClO разлагается:
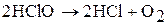
Прим. наибольший практический интерес представляет смешанный хлорид – гипохлорит кальция CaOCl2 (белильная известь) – смесь Ca(ClO)2, CaCl2, Ca(OH)2, который в промышленности получают взаимодействием хлора с гидроксидом кальция:

Белильная известь широко применялась в качестве дезинцифицирующего и отбеливающего средства, а также для получения хлора и кислорода:
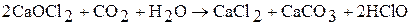


Однако из-за низкого содержания активного хлора (36%) и плохой растворимости в воде ее производство резко сократилось. На смену белильной извести пришли гипохлориты кальция и натрия. Хорошим отбеливающим действием обладает жавелевая вода – раствор, образующийся при насыщении хлором раствора гидроксида натрия.
Соли хлорноватистой кислоты – гипохлориты – являются сильными окислителями. Например:
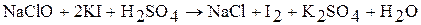
Гипохлориты более устойчивы, чем хлорноватистая кислота, но при комнатной температуре медленно диспропорционируют:
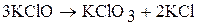
Хлористая кислота HClO2 в свободном виде неустойчива. В разбавленных растворах быстро разлагается:
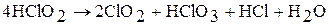
Водные растворы хлористой кислоты получают обработкой хлорита бария Ba(ClO2)2 разбавленной серной кислотой:
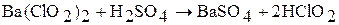
В водном растворе хлористая кислота – кислота средней силы. Хлориты используют для отбеливания.
Соли хлористой кислоты – хлориты. Из солей наибольшее применение находит хлорит натрия, получаемый по реакции:
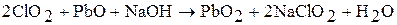
Хлорноватая кислота HClO3 существует только в растворе.
Получают действием разбавленной серной кислоты на раствора соответствующих солей:
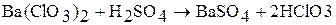
В водном растворе хлорноватая кислота – сильная кислота.
Прим. хлорноватая кислота по свойствам похожа на азотную кислоту, в частности ее смесь с соляной кислотой является сильным окислителем.
Соли хлорноватой кислоты – хлораты. При нагревании хлораты диспропорционируют. Например, при нагревании твердого хлората калия при температуре 500 ºС протекает следующая реакция:
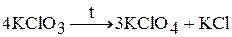
А при более высокой температуре: 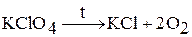
В присутствии катализатора хлорат калия разлагается с выделением кислорода:
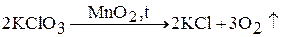
Твердые хлораты являются сильными окислителями.
В смеси с восстановителями хлораты образуют легко взрывающиеся составы. Бертолетову соль используют в производстве спичек и смеси для фейерверков. Хлорат натрия NaClO3 применяется в качестве средства для борьбы с сорняками.
Прим. В водном растворе окислительная способность хлоратов проявляется только в кислой среде.
Хлорная кислота HClO4 Чистая хлорная кислота – бесцветная дымящая на воздухе жидкость, смешивается с водой в любых соотношениях.
Хлорную кислоту получают действием концентрированной соляной кислоты на безводный перхлорат натрия NaClO4:
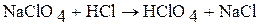
Хлорид натрия, нерастворимый в концентрированной соляной кислоте, отделяют фильтрованием, а фильтрат концентрируют дистилляцией при пониженной давлении в присутствии концентрированной серной кислоты.
Хлорная кислота взрывоопасна, взрывается при соприкосновении с органическими веществами.
Хлорная кислота – одна из наиболее сильных кислот. При охлаждении раствора образуется кристаллогидрат HClO4 × nH2O (n = 1 – 3). Хлорная кислота является окислителем только в концентрированных растворах. При нагревании легко разлагается:
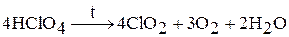
Соли хлорной кислоты – перхлораты. Перхлорат калия получают нагреванием без катализатора:
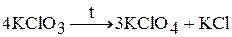
Другие перхлораты получают взаимодействием хлорной кислоты с соответствующими основаниями или карбонатами. Большинство перхлоратов хорошо растворимы в воде (кроме KClO4, RbClO4, CsClO4). Безводный перхлорат магния Mg(ClO4)2 сильно поглощает воду, образуя кристаллогидраты. Это один из наиболее сильных осушителей (техническое название ангидрон). После поглощения воды нагреванием может быть обезвожен.
В растворе перхлораты не проявляют окислительных свойств, но в сухом состоянии при повышенной температуре – одни из сильных окислителей.
|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2846; Нарушение авторских прав?; Мы поможем в написании вашей работы!