
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения брома и йода с положительной степенью окисления
|
|
|
|
Бромноватистая кислота HBrO (гипобромиты) и йодноватистая кислота HIO (гипойодиты) известны только в разбавленных водных растворах. Слабые кислоты. В водном растворе HOBr и HOI диспропорционирует:

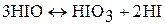
В растворе под действием света или при нагревании разлагаются:


Йодноватистая кислота проявляет амфотерность:  . Существование катиона I+ – проявление металлических свойств йода.
. Существование катиона I+ – проявление металлических свойств йода.
| Свойство | HClO | HBrO | HIO |
| Константа диссоциации | 3,2 × 10–8 | 2,5 × 10–9 | 2,3 × 10–11 |
Кислотные свойства в ряду HClO – HBrO – HIO сила кислот уменьшается. Это объясняется тем, что длина связи О – Г увеличивается, прочность связи О – Г уменьшается, сила кислот уменьшается.
Индукционное влияние галогена на связь О – Н уменьшается с уменьшением электроотрицательности атома галогена. У связи О – Н становится меньше смещение электронной пары, сила кислот уменьшается. Таким образом, сила кислородсодержащих кислот в одной степени окисления в подгруппах уменьшается
Гипобромиты и гипойодиты по свойствам и способам получения подобны гипохлоритам. При нагревании они легко диспропорционируют:

или распадаются, выделяя кислород: 
Гипобромиты и гипойодиты – сильные окислители.
Бромноватая HBrO3 и йодноватая кислоты HIO3
HBrO3 существует только в растворе, а HIO3 выделена в свободном состоянии и представляет собой бесцветные кристаллы.
При концентрации растворов выше 30% данные кислоты разлагаются со взрывом:

Йодноватую кислоту получают окислением йода дымящей азотной кислотой, хлорноватой кислотой или концентрированным раствором пероксида водорода:

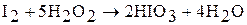
При нагревании происходит дегидратация кислоты:

| Свойство | HClO3 | HBrO3 | HIO3 |
| Константа диссоциации | 101 | 2 × 10–1 | 1,7 × 10–1 |
Стандартный электродный потенциал  , В , В
| 1,45 | 1,45 | 1,08 |
Сила кислот в ряду HClO3 – HBrO3 – HIO3 уменьшается. Это объясняется тем, что с ростом орбитального радиуса атома галогена, прочность кратной связи Х – О уменьшается, что приводит к уменьшению полярности связи О –Н. Все эти кислоты сильные окислители. Окислительные свойства уменьшаются, но у брома они такие же, как и у хлора. Это явление связано со вторичной периодичностью.
Броматы и йодаты получают при взаимодействии брома или йода с раствором щелочи (реакция диспропорционирования):

Твердые броматы и йодаты являются сильными окислителями:

Йодаты устойчивее хлоратов и броматов. Некоторые из йодатов встречаются в природе: KIO3 – как примесь к чилийской селитре, NaIO3 – в виде самостоятельного минерала лаутарита. При нагревании до 300 – 350 ºС в отсутствии катализатора броматы и йодаты разлагаются с выделением кислорода и образованием соответствующего галогенида.
Бромная HBrO4 и йодная кислоты HIO4
Бромная кислота – нестойкая, стабильная в водных растворах, концентрация которых менее 55%, при более высоких концентрациях разлагается.
Соли бромной кислоты – перброматы – получают при взаимодействии фтора броматом в щелочной среде:
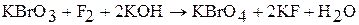
Перброматы – сильные окислители. Кислоту и ее соли используют редко.
Ортойодная кислота (пятиосновная кислота) Н5IO6 – гигроскопичное бесцветное кристаллическое вещество с разложением при 128 ºС.
В водном растворе – слабая кислота (5 × 10–4, 5 × 10–9, 3 × 10–12).
Константы диссоциации по четвертой и пятой ступеням малы, и в водных щелочных растворах можно оттитровать только три первые три протона, что соответствует образованию солей типа NaH4IO6, NaH3IO6 и NaH2IO6. Ортойодную кислоту получают по реакции:
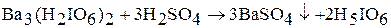
Исходный периодат синтезируют по реакции:


|
|
|
|
|
Дата добавления: 2014-01-20; Просмотров: 2466; Нарушение авторских прав?; Мы поможем в написании вашей работы!