
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 1. Часть 1. Металловедение и термическая обработка металлов
|
|
|
|
Часть 1. Металловедение и термическая обработка металлов.
Введение. Строение и свойства чистых металлов.
1. Предмет и содержание науки «Материаловедение».
2. Классификация материалов и требования к ним.
3. Металлы и их свойства. Металлическая связь.
4. Кристаллическое строение металлов. Типы кристаллических решеток.
5. Анизотропия свойств металлов.
Материаловедение – это наука, изучающая взаимосвязь между составом, строением и свойствами материалов. С развитием техники расширяется ассортимент используемых материалов. Наряду с традиционными, появляются новые материалы, требующиеся в различных областях народного хозяйства и обладающие особыми свойствами. Подобно тому, как 32 буквы алфавита или 7 нотных знаков создают все многообразие языка и музыки, так и элементы таблицы Менделеева позволяют получить неисчислимое множество материалов с разнообразными свойствами. В их числе магнитные, теплопрочные и тугоплавкие, спеченные порошковые материалы, композиционные материалы, ситаллы (стекло – кристаллы или стекло и керамика) и др.
Во все времена технический прогресс всегда был и будет связан с материалами.
Именно с новыми материалами связывают ученые и инженеры решение задач, стоящих перед обществом. Взять, к примеру, управляемую термоядерную реакцию, которая обеспечит человечество энергией на миллионы лет. Сейчас практическая реализация научных идей сдерживается из-за отсутствия мощных сверхпроводящих магнитов. Удастся создать подобные соленоиды, значит осуществится управляемая термоядерная реакция. Нет – решение проблемы века отложится на 10-ти летия. В формуле «технология – материал – технология» заключается одна из важнейших функций материала и его влияние на научно-технический прогресс. Например, титан.
Курс «Материаловедение» включает 2 части. 1 – Материаловедение и термическая обработка металлов; 2 – неметаллические материалы (полимеры, керамика, стекло, резина и т.д.).
Очевидные успехи в создании современных неметаллических материалов должны бы несколько снизить темпы развития некоторых металлургических процессов, но металлы в целом сохранят свое значение как основной материал в машиностроении и в большинстве других отраслей народного хозяйства еще несколько десятилетий. По самым смелым прогнозам, полимеры и композиты уже должны были к 1990 году вытеснить не более 10-ти % черных и около 30% цветных металлов. Для нашей цивилизации металлы останутся незаменивыми, потребность в них будет расти и впредь.
Чтобы изучать материаловедение, необходимо выяснить общее для всех материалов. Для большинства технических материалов характерно кристаллическое строение. Это позволяет с единых позиций рассмотреть закономерности формирования кристаллической структуры и свойств, определяемых природой связи между атомами. Улучшение характеристик уже имеющихся материалов достигается корректировкой химического состава и внешними воздействиями (тепловым, пластическим деформированием). Создаются и принципиально новые материалы.
Металловедение изучает зависимость между составом, строением и свойствами металлов и сплавов и закономерности их изменения под воздействием внешних факторов (тепловых, химических, механических, электромагнитных и радиоактивных).
Впервые осуществление связи между строением стали и ее свойствами было установлено Павлом Петровичем Аносовым (1799-1851г.г.). [Ю. Г. Гуревич «Загадка булатного узора». Знание, 1985, 190 с.]. Имеется в виду секрет булата, основанный на термической обработке.
Основоположником металловедения как науки является Дмитрий Константинович Чернов – русский металлург (1839-1921 гг.). Он показал, что сталь в твердом состоянии при нагреве или охлаждении подвергается фазовым превращениям, вызывающим значительные изменения ее свойств. Д. К. Чернов – основатель современной теории кристаллизации металлов.
Большая роль в развитии металловедения принадлежит н. С. Курнакову (нач. ХХ в.), применившему физико-химические методы анализа для исследования металлов. Им было изучено большое количество систем, построены диаграммы состояния и установлены зависимости между составом, структурой и свойствами различных сплавов.
Кристаллическое строение металлических сплавов и фаз было установлено в начале 20-х годов благодаря широкому использованию рентгеновского анализа, позволившему изучить изменения строения в зависимости от обработки сплава.
Важнейшие исследования в этой области были проведены советскими учеными Г. В. Вульфом, С. С. Штейнбергом, Г. В. Курдюмовым и др. Выполняли их и зарубежные ученые: М. Лауэ и П. Дебай (Германия). У. Г. Брэгг (Англия и др.
В развитие термической обработки большой вклад внесли современные исследователи н. А. Минкевич, Н. Г. Гудцов, А. А. Бочвар.
Металловедение не может не развиваться и в настоящее время. За последние годы созданы новые виды термической и химико-термической обработки стали, разработаны основы легирования стали, созданы коррозионно-стойкие, высокопрочные стали и сплавы, а также стали и сплавы на основе Al, Ti и других металлов. Все более широко применяются редкие металлыи их сплавы.
Металловедение тесно свяхано с другими науками – общетехническими (физхимия, химсопромат) и технологическими (технология конструкционных материалов), специальными.
2. Классификация материалов и требования к ним.
Все материалы, применяемые в машиностроении, целесообразно разделить на 2 основные группы: металлические и неметаллические.
К металлическим относятся металлы и их сплавы. В природе приблизительно 4/5 всех элементов приходится на долю черных и цветных металлов.
Железо и сплавы на его основе (сталь, чугун) принято называть черными металлами. Сюда же можно отнести тугоплавкие металлы (W, V, Mo).
К цветным металлам относятся:
а) легкие металлы (γ < 5 г/см3). Это Mg, Al, Be, Ti (1,74; 2,7; 1,82; 4,54).
б) тяжелые (γ > 5 г/см3) – Cu, Ni, Pb (8,9; 8,9; 11,34).
в) легкоплавкие – Zn, Cd, Hg, Bi, Sn (419,5; 321; -38,9 °С тпл/кр; 271; 232 °С).
г) благородные металлы – Ag, Au, Pt, Pd, Os.
Неметаллические материалы могут быть органического и неорганического происхождения. К органическим относятся полимерные материалы (пластмассы, каучуки, резина), углеграфитные материалы, дерево.
Неорганические материалы подразделяются на:
а) горные породы; б) керамические материалы; в) искусственные плавленые силикатные материалы (стекло, эмали).
Материалы должны обладать необходимой механической прочностью и достаточным запасом пластичности.
Ежегодно 1/3 металлических материалов выходит из строя в результате коррозии, поэтому важным требованием является высокая коррозионная стойкость.
В ряде отраслей техники необходима высокая жаропрочность, т.е. способность материалов сохранять необходимую прочность при работе в области высоких температур.
При низких температурах металлы могут переходить в хрупкое состояние. Для предотвращения этого металл должен обладать стойкостью к хладноломкости.
Во всех случаях учитывается экономическая целесообразность использования того или иного материала. Иногда предъявляются специфические требования, например, определенная степень чистоты.
3. Металлы и их свойства. Металлическая связь.
Известно в настоящее время 80 металлов. Они занимают 4/5 всех клеточек таблицы Менделеева. Металлам характерны следующие свойства:
Высокая тепло - и электропроводимость.
Положительный коэффициент электрического сопротивления. С повышением температуры электрическое сопротивление возрастает. Большое число металлов (примерно 30) обладают сверхпроводимостью. При температуре, близкой к абсолютному 0 электрическое сопротивление этих металлов скачкообразно падает до 0.
Способность испускать электроны при нагреве (термоэлектронная эмиссия).
Отражательная способность, непрозрачность и металлический блеск.
Повышенная способность к пластической деформации. При наличии этих свойств достигается так называемое металлическое состояние вещества.
Металлоиды, в отличие от металлов, как правило, хрупки, не обладают металлическим блеском, характеризуются низкой тепло- и электропроводимостью и отрицательным коэффициентом электрического сопротивления.
Все наиболее характерные свойства металлов объясняются наличием в них легкоподвижных электронов проводимости.
Как известно, атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Различают внешние (валентные) электроны, связь которых с ядром незначительна и внутренние – более прочно связанные с ядром.
Внешние электроны способны отщепляться от атомов и находится в относительно свободном состоянии, образуя электронный газ. Положительно заряженные ионы стягиваются отрицательно заряженным электронным газом в кристалл.
Атомы в металлах располагаются близко один к другому. Это означает, что наблюдается значительное перекрывание орбиталей внешних электронов и что валентные электроны фактически связаны не с отдельным ядром, а делокализованы по всем атомам металла. Таким образом, металл представляет собой ионно-электронную систему, устойчивость которой определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами. Такое взаимодействие между ионами и электронным облаком называется металлической связью.
Сила связи в металле определяется силами отталкивания и силами притяжения между ионами и электронами, не имеющими резко выраженного направленного характера.
Атомы или ионы располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной.
Различают 4 типа металлической атомной связи – ионную, ковалентную, полярную и металлическую.
Ионная связь возникает у разнородных атомов, когда какой-либо из них отдает с внешней оболочки, а другой принимает 1 или несколько электронов. Образующиеся при этом положительные и отрицательные ионы с завершенными внешними оболочками благодаря электрическим силам взаимно притягиваются.
Ковалентная связь возникает обычно у одинаковых атомов и осуществляется парами валентных электронов, которые одновременно принадлежат 2-м соседним ионам, находящимся в узлах решетки. Связь имеет резкую направленность и высокую прочность. Этот тип связи характерен для соединений углерода.
Полярная связь возникает вследствие смещения электронной плотности в молекулах к более электроотрицательному атому и появления слабого электрического притяжения.
Приведенные положения позволяют объяснить характерные свойства металла.
Электрическая проводимость – наличием в металле свободных электронов, которые под влиянием разности потенциалов перемещаются от отрицательного полюса к положительному. С повышением температуры усиливаются колебательные движения ионов, что затрудняет прямолинейное движение электронов, в результате чего возрастает электрическое сопротивление.
При низких температурах колебательное движение ионов сильно уменьшается и электропроводимость возрастает. У некоторых металлов в результате упорядоченного движения пар электронов при очень низких температурах (< 200К) электрическая проводимость обращается в ∞ (сверхпроводимость).
Высокая теплопроводимость металлов обусловливается как большой подвижностью свободных электронов, так и колебательными движениями ионов, вследствие чего происходит быстрое выравнивание температуры в массе металла.
Высокая пластичность металла объясняется периодичностью их атомной структуры и ненаправленностью металлической связи. В процессе пластической деформации (ковка, прокатка), т.е. при смещении объемов металла, связь между ионами не нарушается.
Направленность – важнейшее свойство ковалентной связи, определяющее геометрию молекулы. Причина направленности заключается в том, что перекрывание облаков, образующих химическую связь, происходит в направлении набольшей плотности их (наибольшей вытянутости), например, Cl2 ∞∞.
Кристаллы с ковалентной связью хрупки, т.к. при деформации связь нарушается.
4. Кристаллическое строение металлов. Типы кристаллических решеток.
Все металлы и их сплавы – тела кристаллические и, в отличие от аморфных тел с хаотичным расположением атомов, в металлах они расположены закономерно.
Металлы, полученные обычным способом, поликристалличны и состоят из большого числа мелких (10-1 ÷ 10-5 см) различно ориентированных по отношению другш к другу кристаллов, имеющих неправильную форму (вследствие условий кристаллизации) и называемых кристаллитами или зернами.
Гипотеза о закономерности расположения частиц в кристаллах была выдвинута в 1860 году Е. С. Федоровым и доказана в 1912 году м. Лауэ с помощью рентгеноструктурного анализа.
Косвенным доказательством кристалличности строения металлов может служить термический анализ. Если tзатв=f(τ) и для чистых металлов строго постоянна, то график охлаждения вещества будет иметь следующий вид:

Т.е. закономерности неодинаковы для кристаллических и аморфных веществ.
Переход кристаллического вещества из жидкого состояния в твердое происходит при температуре кристаллизации (Ткр.). Процесс перехода протекает в определенный промежуток времени и сопровождается выделением скрытой теплоты кристаллизации. Поэтому, несмотря на охлаждение металлов, температура в течение данного времени остается неизменной (горизонтальный участок). Скрытая теплота затвердевания компенсирует потерю тепла в пространстве.
Затвердевание аморфного вещества происходит постепенно без резко выраженной границы между жидким и твердым состоянием.
Структура (строение) аморфного вещества характеризуется беспорядочной пространственной сеткой, в узлах которой расположены ионы, атомы или гр. атомов.
Для описания кристаллической структуры веществ пользуются понятием кристаллической решетки.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл.
Для металлов характерны сравнительно простые типы кристаллических решеток с высокой плотностью упаковки атомов. Расположение атомов в кристалле удобно изображить в виде так называемых элементарных кристаллических ячеек. Это наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме.
Различают:
1. Простая кубическая (на долю одной элементарной ячейки – 1 атом)
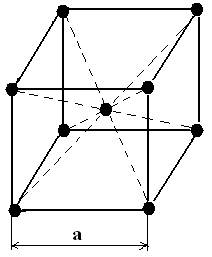
2. Объемноцентрированная (ОЦК) кубическая.
Кубическую решетку определяет длина ребра куба [а] = ангстрем, А
Ао=10-10м=10-8см α-Fe, W, V, Mo
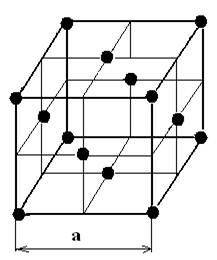
3. Гранецентрированная (ГЦК)
α-Fe, Al, Cu
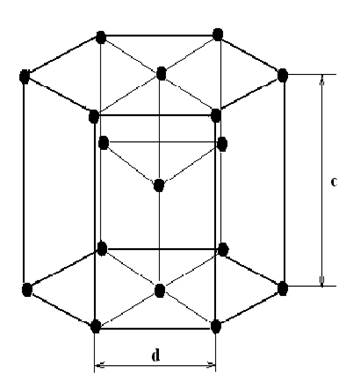
4.Гексагональная плотноупакованная (ГПУ)
Размеры характеризуются const значением c/d=1,633. При иных соотношениех c/d получается неплотноупакованная решетка. Mg, Zn, Re, Os.
Геометрию и плотность упаковки элементарных частиц в кристалле отражают такие понятия, как координационое число (КЧ) и коэффициент компактности (КК). Координационное число определяет число ближайших равноудаленных элементарных частиц.
Коэффициент компактности определяет отношение объема всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки.
| Показатели | Тип решетки | |||
| Кубич. | ОЦК | ГЦК | ГПУ | |
| К.Ч. | ||||
| К.К. | 0,52 | 0,68 | 0,74 | 0,74 |
4. Анизотропия свойств кристаллов.
Анизотропия – это векториальность, неодинаковость свойств кристалла в разных кристаллографических направлениях, возникающая в результате упорядоченного расположения атомов (ионов) в пространстве. Различны расстояния между атомами в разных кристаллографических направлениях, различны и свойства, т.к. последние определяются взаимодействием атомов. Наиболее сильно анизотропия проявляется в кристаллах со структурами, обладающими малой симметрией. Анизотропия присуща всем свойствам кристаллов и особенно важна при использовании монокристаллов (т.е. кристаллов, полученных искусственным путем). В природных условиях кристаллические тела, как уже отмечалось, поликристалличны и состоят из множества мелких, различно ориентированных кристаллов. В этом случае анизотропия не проявляется, т.к. среднестатистическое расстояние между атомами по всем направлениям примерно одинаково. В связи с этим поликристаллические тела считают мнимоизотропными.
При обработке поликристаллов давлением кристаллографические плоскости одного индекса (индексы направления – это координаты узла кристаллической решетки, выраженные целыми числами u, υ, ω, в единицах отрезков а, в, с) в различных зернах могут ориентироваться параллельно. Такие поликристаллы называют текстурованными и они подобно монокристаллам, анизотропны. У аморфных тел свойства не зависят о направления.
ЛЕКЦИЯ 2
ПРОЦЕССЫ ПЛАВЛЕнИЯ И КРИСТАЛЛИЗАЦИИ МЕТАЛЛОВ
Понятие о процессах плавления и кристаллизации. Условие кристаллизации. Термические кривые.
1.Процессы зарождения и роста кристаллов.
2. Строение слитков.
3. Скорость процесса кристаллизации.
4. Величина зерна. Модифицирование.
5. Методы исследования кристаллического строения металлов.
6. Диффузия.
Кристаллизацией называют переход металла из жидкого состояния в твердое (кристаллическое). Известно, что все вещества могут находиться в твердом, жидком, газообразном состояниях. При определенных температурах происходит изменение агрегатного состояния чистых металлов. При нагреве выше температуры плавления (Тпл). Твердое состояние сменяется жидким, а при нагреве выше температуры кипения (Тк) жидкое состояние сменяется газообразным.
Главным признаком твердого состояния является кристаллическое строение. Жидкий расплав характеризуется хаотическим тепловым движением атомов и молекул металла.
Процесс плавления металла заключается в разрушении кристаллического строения при достижении Тпл.
Затрачиваемая на разрушение кристаллических решеток энергия является для каждого металла величиной постоянной и характеризуется теплотой плавления.
Тпл для различных металлов находится в пределах от –38,9 (Hg) до +3410 °С (W).
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с меньшей свободной энергией Z, т.е. когда Zкр < Zж.
Свободная энергия определяется Z=U-TS, где
U – полная внутренняя энергия системы
T – абсолютная температура
S – энтропия
Свободной энергией (термодинамическим потенциалом) называют ту составляющую полной энергии вещества, которая обратимо изменяет свою величину с изменением температуры. С повышением температуры Z уменьшается.
Изменение свободной энергии Z жидкого и твердого состояния в зависимости от температуры показано на рисунке:

Выше Ts более устойчив жидкий металл, имеющий меньший запас свободной энергии, ниже Ts – устойчив твердый металл. При Ts Zж=Zтв. При этой температуре жидкая и твердая фазы могут существовать бесконечно долго. Отклонение в ту или иную сторону является термодинамическим стимулом для плавления или кристаллизации.
Процесс кристаллизации развивается, когда созданы условия для возникновения разности свободных энергий, образующейся вследствие меньшей свободной энергии твердого металла по сравнению и жидким.
Таким образом, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры Ts
Разность между Ts и Ткр, ∆ Т=Ts – Ткр называется степенью переохлаждения.
Изобразим термические кривые, характеризующие процесс кристаллизации металла при разных скоростях охлаждения:
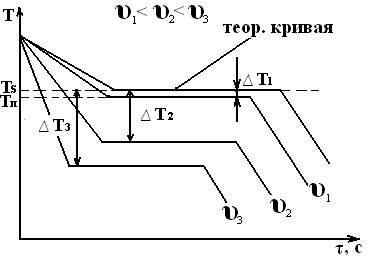
При очень медленном охлаждении ∆Т невелика и кристаллизация протекает при температуре, близкой к равновесной. С увеличением υохл ∆Т возрастает. Для полного переохлаждения металла в жидком состоянии требуются большие скорости охлаждения (миллионы и даже миллиарды °/с). Охлаждение жидкого металла до комнатной температуры следует проводить так, чтобы получить переохлажденный жидкий металл (т.е. не имеющий кристаллического строения) за ничтожную долю секунд. Такой металл называется аморфным или металлическим стеклом. Начинает применяться на практике. Степень переохлаждения зависит от природы и чистоты металла. Чем чище металл, тем более склонен он к переохлаждению, например, при затвердевании Sn была достигнута ∆Т=1180С, но скачок указывает на то, что в результате переохлаждения образуется большое число центров кристаллизации, рост кристаллов происходит так бурно, что температура скачкообразно повышается, чаще степень переохлаждения не более 10-30оС.
Скачок на кривой охлаждения указывает на то, что в результате большего переохлаждения образуется большее число центров кристаллизации, рост кристаллов происходит так бурно, что температура скачкообразно повышается почти до температуры плавления. Это характерно для Sb, температура переохлаждения 631 – 590 = 41 °С.
На перевод жидкого металла в газообразное состояние также затрачивается энергия, характеризующаяся температурой кипения (Ткип).
2. Процесс зарождения и роста кристаллов.
Итак, кристаллизация – это процесс образования кристаллов. Различают первичную и вторичную кристаллизацию. Первичная – образование кристаллов из жидкости в процессе затвердевания металла, вторичная – изменение кристаллического строения в твердом состоянии.
Кристаллизация, как впервые установил Д. К. Чернов, происходит не мгновенно по всему объему, а развивается постепенно. Она объединяет 2 элементарных процесса: возникновение центров кристаллизации (зародышей) и рост кристаллов из центров кристаллизации.
Центрами кристаллизации являются либо затвердевшие мельчайшие частицы металла, либо посторонние твердые примеси, находящиеся в жидком металле. По мере протекания процесса кристаллизации происходит как зарождение новых центров кристаллизации, так и рост кристаллов.
Пока образовавшиеся кристаллы растут свободно и окружены жидкостью, они имеют правильную форму. Однако при столкновении и сростании кристаллов их форма нарушается.


После затвердевания металла получаются кристаллы неправильной формы, границы которых чаще всего принимают округлые очертания. Такие кристаллы называют зернами или кристаллитами. Внутри каждого зерна наблюдается определенная ориентация кристаллической решетки, отличная от ориентации соседних зерен.
3. Строение слитков.
В зависимости от условий роста, главным образом от скорости направления отвода теплоты, температуры жидкого металла, форма зерен может быть самой разнообразной.
При кристаллизации металлов и их сплавов рост зерен осуществляется по дендритной (древовидной) схеме. Рост дендрита происходит путем образования осей 1 порядка (стволов), перпендикулярно к которыым вырастают ветвиП порядка, перпендикулярно к ним ветви 3-го порядка и т.д. Большая скорость роста кристаллов наблюдается по таким плоскостям и направлениям решетки, которые имеют наибольшую плотность упаковки атомов, в результате чего и вырастают оси 1 порядка. Одновремено с ростом ветвей П и т.д.порядков идет кристаллизация между осями дендритов.


После соприкосновения дендритов и окончательного заполнения межосного пространства, дендриты превращаются в полновесные кристаллиты.
Кристаллизация слитка идет в три стадии. Схема:

Как видно, условия отвода тепла при кристаллизации значительно влияют на форму зерен. Сначала на поверхности слитка образуется зона 1 – мелкозернистая корка, состоящая из разнообразно ориентированных мелких дендритов. При первом соприкосновении со стенками изложницы в тонком прилегающем слое жидкого металла возникает резкий градиент температуры и явление переохлаждения, ведущее к образованию большого количества центров кристаллизации.
2-я зона – зона столбчатых кристаллов. С образованием корки условия теплоотвода меняются, градиент температуры резко уменьшается и, следовательно, уменьшается степень переохлаждения металла. В результате из небольшого числа центров кристаллизации начинают расти нормально ориентирванные к поверхности корки (т.е. в направлении отвода тепла) столбчатые кристаллы.
3-я внутренняя зона состоит из крупных, различно ориентированных дендритов. В центре слитка уже нет определенной направленности отдачи тепла. Температура застывающего металла успевает почти совершенно уравниваться в различных точках. В результате образуется равноосная структура. Зародышами кристалла здесь являются обычно различные мельчайшие включения в жидкой стали, например, тугоплавкие составляющие.
В случае сильного перегрева и резкого охлаждения зона столбчатых кристаллов заполняет весь слиток. Структура такого слитка называется транскристаллической, она менее прочна.
Свойства металла зависят от относительного распределения зон столбчатых и равноосных кристаллов. В зоне столбчатых кристаллов металл более плотный, он содержит меньше раковин и газовых пузырей. Однако места стыка столбчатых кристаллов обладают малой пластичностью. Ввиду скопления большого количества неметаллических включений и при последующей горячей обработке (ковка, штамповка) в этих местах могут получаться трещины. Поэтому для малопластичных металлов (в том числе и для стали) нежелательно развитие транскристаллизации. Для пластичных сплавов и металлов (Cu, Al и др.) развитие транскристаллизации желательно.
Жидкий металл имеет больший объем, чем закристаллизовавшийся. Залитый в форму металл в процессе кристаллизации сокращается в объеме, поэтому образуются пустоты, называемые усадочными раковинами. Раковины могут быть либо сконцентрированы в одном месте, либо рассеяны по всему объему слитка.
В хорошо раскисленной [раскисление – процесс удаления из сваренной стали О2, которая присутствует в виде FeO] отлитой в изложницу стали, усадочная раковина образуется в верхней части слитка и в объеме всего слитка содержится малое количество газовых пузырей и раковин. Сталь, недостаточно раскисленная, так называемая кипящая, содержит раковины и пузыри во всем объеме.
Спокойная сталь, т.е. раскисленная Mn, Si, Al с концентрированной усадочной раковиной, лучше стали кипящей, раскисленной только Mn. Однако и кипящие стали имеют применение, т.к. они дешевые и их производство дает меньше отходов.
В спокойном металле в отходы идет верхняя и нижняя части слитка, а раковины и пустоты, равномерно распределенные по объему слитка кипящего металла, при прокатке завариваются.
4. Скорость процесса кристаллизации.
При прочих равных условиях, скорость процесса кристаллизации и строение металла после затвердевания зависят от числа центров кристаллизации, возникающих в единице времени, в единице объема, т.е. от скорости образования зародышей [1/см3∙с] υз и скорости роста зародышей, или скорости увеличения минимальных размеров растущего кристалла в единице времени υр [мм/с].
Чем больше скорость υз и υр, тем быстрее протекает процесс кристаллизации. При равновесной температуре кристаллизации Тs (пл-кр) число центров и скорость роста равны нулю и поэтому кристаллизация не происходит.
. 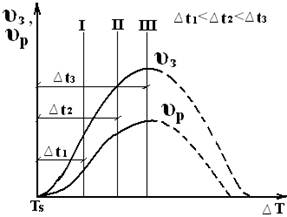

При увеличении степени переохлаждения до определенной величины ∆ Т=Тs-Ткр υз и υр возрастают, достигая максимума, после чего снижаются. Обычно скорость образования зародышей растет более резко, поэтому с увеличением степени переохлаждения получают все более мелкие кристаллы
Характер кривых объясняется тем, что для образования зародышей необходимо не только увеличение разности свободных энергий жидких и твердых металлов ∆Z, но и диффузионное перемещение атомов в жидком металле. Очень низкие температуры снижают подвижность атомов настолько, что большой выигрыш ∆ Z оказался недостаточным для образования зародышей и их роста (υз = 0 и υр = 0). В результате затвердевания в таком случае должно быть достигнуто аморфное состояние.
Металлы обычно кристаллизуются раньше, чем достигается степень переохлаждения, вызывающая снижение υз и υр, т.е. реализуются только восходящие ветви скорости образования зародышей и скорости роста.
5. Величина зерна.
Величина зерна находится в следующей зависимости от числа зародышей и скорости их роста:
Чем больше скорость образования зародышей и меньше скорость их роста, тем меньше размер кристалла. При небольшой степени переохлаждения число зародышей мало и зерно крупное, с увеличением ∆ Т скорость образования зародышей возрастает, и размер зерна в затвердевшем металле уменьшается.
Величина зерна сильно влияет на механические свойства сплава, в частности, вязкость и пластичность выше, если металл мелкозернист. Величина зерна зависит от температуры нагрева и разливки жидкого металла, его химического состава и присутствия примесей.
В настоящее время в производстве черных и цветных металлов широко практикуется процесс искусственного регулирования размеров и формы зерен путем введения в расплавленный металл нерастворимых веществ. Этот процесс называется модифицированием, а примеси, воздействующие на структуру – модификаторами. Благодаря равномерному распределению искусственных примесей по всему объему жидкого металла, зерна получаются мелкими и несколько иной формы. Такое изменение структуры металла улучшает его механические и технологические свойства.
6. Методы исследования кристаллического строения металла.
Внутреннее строение металлов и сплавов изучается с помощью рентгеноструктурного и металлографического анализов.
Строение кристаллических решеток, ориентацию кристаллических плоскостей, внутренние напряжения в решетках изучают рентгеноструктурным методом.
Внутреннее строение, определяемое рентгеноструктурным анализом, называется атомнокристаллической структурой.
Металлографический анализ делится на макро- и микроанализ и позволяет определить размеры, форму и расположение кристаллов.
Макроанализ заключается в исследовании строения металлов и сплавов невооруженным глазом или при небольших увеличениях (до 30 раз).
Строение, определенное термической обработкой, называется макроструктурой. Исследования проводят на макрошлифах или изломах. Макроанализ позволяет установить:
1.Строение металла (зернистое, дендритное); наличие зон кристаллизации, трещин, пузырей и т.д..
2. Химическую неоднородность (ликвацию), получаемую при кристаллизации. S, F, C имеют склонность к неравномерному распределению по сечению слитка, что сильно сказывается на свойствах. Это явление не устраняется последующей обработкой.
3. Строение после горячей обработки (волокна).
4. Определить характер разрушения металла (вязкость, хрупкость).
Микроанализом называют исследование внутреннего строения металла с помощью оптического микроскопа при увеличении от 30-50 до 1500-1800 раз и электронного при увеличении от 15000 до 60000 раз. Внутреннее строение, изучаемое с помощью микроскопа, называется микроструктурой или структурой. Впервые применил Павел Петрович Аносов (1831 г.). Микроструктурный анализ проводят с целью определения микроструктуры и фазового состава сталей и сплавов, оценки количества, размеров, формы и распределения различных фаз. Этот анализ позволяет установить связь химического состава, условий производства и обработки сплава с его микроструктурой и свойствами.
7. Диффузия.
Многие процессы, протекающие в металлах и сплавах, в том числе кристаллизация, носят диффузионный характер.
В кристаллическом теле под диффузией понимают перемещение атомов на расстояния, превышающие средние межатомные расстояния данного вещества. Если процесс перемещения атомов не связан с изменением концентрации в отдельных объемах, то процесс называется самодиффузией.
Самодиффузия – это перемещение атомов основного металла в своей собственной кристаллической решетке.
Диффузия, сопровождающаяся изменением концентрации, происходит в сплавах с повышенным содержанием примесей и называется гетеродиффузией.
Каждый атом совершает случайные блуждания, т.е. ряд скачков между различными равновесными положениями в решетке. Любая атомная теория должна начинаться с рассмотрения механизма, объясняющего, каким образом данный атом перемещается в решетке.
Для описания процесса диффузии в твердом теле предложено несколько возможных механизмов: циклический, обменный, вакансионный, межузельный.
 По циклическому механизму диффузии перескок представляет собой совместное перемещение группы атомов (вращение). Такое вращение не требует большой энергии, но маловероятно.
По циклическому механизму диффузии перескок представляет собой совместное перемещение группы атомов (вращение). Такое вращение не требует большой энергии, но маловероятно.
 Обменный механизм является частным случаем циклического (гр. из 2-х атомов) и заключается в обмене соседних атомов.
Обменный механизм является частным случаем циклического (гр. из 2-х атомов) и заключается в обмене соседних атомов.
 При вакансионном механизме диффузии атомы обмениваются местами с вакансией.
При вакансионном механизме диффузии атомы обмениваются местами с вакансией.
 При межузельном механизме атом переходит в состояние равновесия в ближайшее междоузлие.
При межузельном механизме атом переходит в состояние равновесия в ближайшее междоузлие.
В металлах диффузия преимущественно осуществляется по вакансионному механизму. При диффузии в металле элементов с малым атомным радиусом (С, N2, H2) механизм межузельный.
Скорость диффузии определяется количеством вещества m, диффундирующего через единицу площади поверхности раздела в единицу времени. m зависит от градиента концентрации элемента dc/dx в направлении, перпендикулярном к поверхности раздела и пропорционально коэффициенту Д: dx
m= - Д dc - закон Фика.
Знак «-» указывает, что диффузия протекает в направлении от объемов с большей концентрацией к объемам с меньшей концентрацией.
Коэффициент Д [см2/с] – количество вещества, диффузирующего через единицу площади 1 см2 в единицу времени (1 с.) при перепаде концентраций равном 1. Коэффициент зависит от природы сплава, размеров зерна и от температуры.
“Д” в твердых сплавах крайне чувствителен к дефектам кристаллической решетки, возникающим при нагреве, напряжениях, деформациях и других воздействиях. Увеличение числа дефектов (главным образом вакансий) облегчает перемещение атомов и приводит к росту “Д”.
Лекция 3
ПРЕВРАЩЕНИЯ МЕТАЛЛОВ В ТВЕРДОМ СОСТОЯНИИ.
МЕТАЛЛИЧЕСКИЕ СПЛАВЫ.
1. Полиморфизм.
2. Магнитные превращения.
3. Основные понятия о сплавах.
4. Механические смеси.
5. Химические соединения в сплавах.
6. Твердые растворы.
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако, реально существующим типом решетки, наиболее устойчивым, является решетка с низким запасом свободной энергии.
В ряде случаев при изменении температуры и давления для одного и того же металла становится устойчивой другая решетка.
Существование металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии.
Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями.
Аллотропические изменения характерны для таких металлов, как Co, Al, Sn, Mn, Ti, Zn, U, Fe. Это металлы, имеющие большое практическое значение.
Аллотропические формы обозначаются греческими буквами α, β, γ, δ и т.д. по мере повышения температуры. Т.е. при самой низкой температуре аллотропическая форма обозначается α. Эти индексы добавляются к соответствующим химическим символам.
Полиморфизм основан на законе устойчивости состояния с наименьшим запасом энергии, а запас свободной энергии зависит от температуры. Поэтому в одном интервале температур устойчива α-форма, а в другом – β и т.д.
Температура, при которой осуществляется переход из одной модификации в другую, называется температурой аллотропического превращения.
Полиморфные превращения происходят путем зарождения центров и роста кристаллов и имеют свои особенности для различных металлов. Рассмотрим аллотропические превращения на примере Fe.
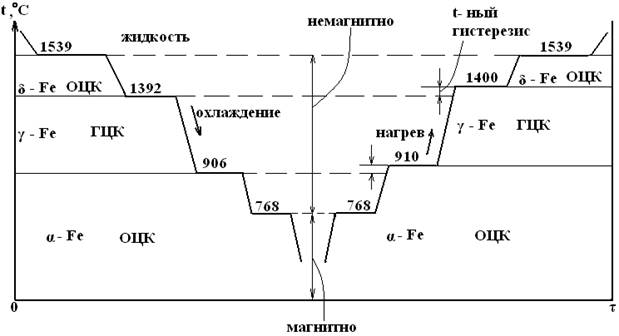
При температуре до 910 °С железо существует в форме α. При 9100С ОЦК Feα переходит в ГЦК Feγ, которая при 14000С вновь превращается в ОЦК Feα. Высокотемпературная α-решетка обозначается также δ (дельта). Таким образом, у железа одна и та же решетка устойчива в 2-х интервалах температур.
При температуре 7680С получается горизонтальный участок на кривой охлаждения, связанный не с перестройкой решетки, а с изменением магнитных свойств. Выше 7680С Fe магнитно и называют его иногда β (бэта) – Fe. Оно более пластично, вызко, обладает большей растворимостью углерода. При температуре 15390С – ОЦК трансформируется в жидкость.
Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой в координатах температура-время превращение отмечается горизонтальным участком. При охлаждении происходит выделение тепла (скрытой теплоты превращения), что приводит также к постоянству температуры. Вследствие переохлаждения эта температура более низка, чем при нагреве (возникает температурный гистерезис) – разница между реальными температурами плавления и кристаллизации.
Таким образом, суть аллотропических превращений заключается в переходе кристаллических решеток из одной в другую. Явление полиморфизма имеет большое практическое значение. На существовании аллотропических превращений основана термическая обработка стали.
2. Магнитные превращения.
Другим видом превращений в твердом состоянии являются магнитные превращения. И магнитные и полиморфные превращения называют вторичными, т.к. они происходят после кристаллизации.
Некоторые металлы, например, Fe, Co, Ni обладают способностью хорошо намагничиваться, т.е. эти металлы ферромагнитны. Но при нагреве ферромагнитные свойства металла постепенно теряются. Полная потеря ферромагнитных свойств происходит при определенной температуре, названной точкой Кюри, поскольку открыл это явление П. Кюри. Магнитные свойства Fe, Co, Ni в зависимости от температуры изменяются следующим образом:
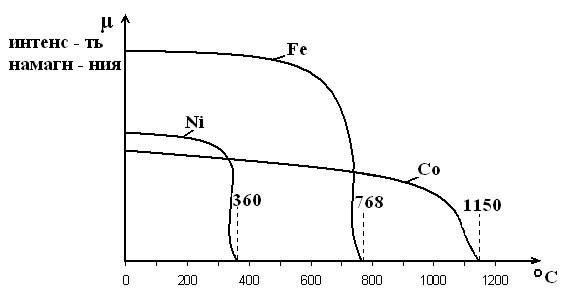
Сказанное не противоречит графическим данным: интенсивность намагничивания с повышением температуры постепенно снижается. Т.Кюри соответствует окончательной потере ферромагнетизма.
Магнитные превращения, в отличие от аллотропических, не сопровождаются изменением кристаллической решетки, перекристаллизацией (образованием новых зерен) и тепловым гистерезисом. Т.Кюри не означает скачкообразное изменение свойств. Механические и некоторые физические свойства не изменяются, изменяются электромагнитные и тепловые свойства.
Согласно современным представлениям, при магнитных превращениях происходят изменения во взаимодействии внешних электронных оболочек атомов.
3. Основные понятия о сплавах.
Чистые металлы не всегда отвечают требованиям, предъявляемым в современном машиностроении и других отраслях народного хозяйства, поэтому чаще в технике применяются сплавы.
Под сплавом понимают вещество, полученное сплавлением 2-х или более элементов. Они могут содержать и неметаллические элементы, сохраняя при этом свойства металла. В каждом сплаве различают компоненты (элементы) сплава и фазы [однородные части сплава с подобным кристаллическим строением и одинаковыми свойствами]. В зависимости от количества фаз сплавы могут быть однофазными, 2-х фазными и т.д.
Сплавы обладают большим диапазоном свойств по сравнению с чистыми металлами; легче поддаются термической и термомеханической обработке. В ряде случаев являются дешевле чистых металлов. В металлических сплавах основу составляют металлы:
Сталь - Fe (до 2,14%С)
Латунь - Cu (более 50% Cu; Zn)
Дуралюмин - Al (Al более 90%, Cu 4, Mg 0,5, Mn 0,5)
Строение сплава сложнее строения чистого металла и зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав.
Различают 3 типа взаимодействия:
1. Компоненты сплава могут химически взаимодействовать между собой, образуя химические соединения (AlSb, GaAs, InSb и др.).
2. Взаимно растворяться друг в друге, образуя твердые растворы, например, Ag - Au – неограниченный, Ni - Cu – неограниченный, Cu-Al – ограниченный (с эвтектикой).
3. Строение сплава может быть механической смесью отдельных частиц или зерен компонентов.
4. Механические смеси.
Примером механической смеси в сплавах является система Pb-Sb. Механические смеси образуются тогда, когда компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соответствующего соединения. Основные признаки:
1. На микроструктуре такого сплава можно четко выделить кристаллы отдельных компонентов.

2. При рентгеноструктурном анализе твердого сплава можно наблюдать наличие 2-х типов кристаллических решеток.
3. Механические и другие свойства сплавов изменяются пропорционально изменению концентрации компонентов.
Если исследовать отдельно в сплавах механической смеси (как и в других сплавах) свойства кристаллов Рв и кристаллов Sb, то они тождественны со свойствами чистых компонентов.
5. Химические соединения в сплавах.
Они характеризуются определенным соотношением количества атомов элементов в соответствии со стехиометрической пропорцией (согласно формуле). При этом образуется более сложная кристаллическая решетка с упорядоченным расположением атомов, отличающаяся от решеток составляющих компонентов.
Химические соединения характеризуются также определенной температурой плавления (Тпл), скачкообразным изменением свойств при изменении состава (сингулярность свойств). Образование химических соединений сопровождается тепловым эффектом.
Если химическое соединение образуется только металлами, то в узлах решеток располагаются положительно заряженные ионы, удерживаемые электронным газом, т.е. имеет место металлическая связь.
Могут образовываться 2 вида химических соединений:
1. Химические соединения, подчиняющиеся правилу валентности, т.е. характеризующиеся наличием свободных (валентных) электронов и достроенностью электронных орбит у вступающих в соединение компонентов, например, Mg2Sn, MgS и др. Связь в этом случае жесткая и химический состав постоянный, т.е. не может быть избытка или недостатка в атомах какого-либо элемента.
2. Химические соединения, не подчиняющиеся правилу валентности. Образующаяся связь не является жесткой и поэтому количество какого-либо элемента может быть больше или меньше, чем это соответствует данной формуле химического соединения.
Таким образом, характерные признаки химических соединений таковы:
1. Определенное соотношение компонентов.
2. Сложность кристаллической решетки, отличающаяся от решеток составляющих компонентов.
3.Свойства сплава – химического соединения резко отличаются от свойств отдельных компонентов. Например, НВ Fe=50-150 кг/мм2; НВ графита=0; а НВ Fe3C>850 кг/мм2
Твердость по Бринеллю (НВ, Нв) устанавливается вдавливанием в образец испытываемого материала закаленного стального шарика определенного диаметра под действием заданной нагрузки в течение определенного времени с последующим измерением глубины и диаметра отпечатка. Число твердости:
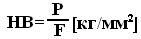
2. Твердые растворы.
В жидком состоянии большинство металлических сплавов представляет собой растворы. При переходе в твердое состояние во многих сплавах однородность строения сохраняется, следовательно, сохраняется и растворимость. Твердая фаза, образующаяся при кристаллизации такого сплава, называется твердым раствором. При этомы одного компонента (растворимого) определенным образом размещаются в кристаллической решетке другого компонента (растворителя). Растворителем может быть чистый металл или химическое соединение.
Характерные признаки твердого раствора:
1. При микроструктурном анализе невозможно выделить зерна отдельных компонентов.
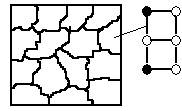
Схема микроструктуры твердого раствора.
● - атом компонента А
○ - атом компонента В
2. При рентгеноструктурном анализе выявляется только один тип кристаллической решетки, а именно кристаллическая решетка растворителя.
3. Механические и другие свойства сплава не изменяются пропорционально количеству компонентов.
Следовательно, в отличие от механической смеси, твердый раствор однофазен (имеет одну кристаллическую решетку), а в отличие от химического соединения твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций.
Различают 2 основных типа твердых растворов:
1. Твердые растворы замещения.
2. Твердые растворы внедрения.
Твердые растворы замещения образуются в случае, когда часть атомов в кристаллической решетке компонента В замещается атомами компонента А.

Замещение атомами А происходит незакономерно, беспорядочно.
Существуют:
а) твердые растворы замещения с неограниченной растворимостью компонентов. Например, система Cu-Ni (до 50% Ni - основа Cu, более 50% Ni - основа Ni).
Для образования таких растворов необходимы следующие условия:
1. Одинаковость типов кристаллических решеток компонентов.
2. Малая разница в размерах, диаметрах атомов компонентов, не более 10%.
3. Одинаковое строение электронных оболочек у взаимодействующих компонентов.
б) твердые растворы с ограниченной растворимостью.
1-е условие соблюдается, 2 и 3 могут не соблюдаться, например, Al-Cu сплав, при температруре 200С в Al – 0,5% Cu, при температуре 5470С в Al – 5,72% Cu.
Твердые растворы внедрения образуются путем внедрения атомов растворимого компонента в промежутке между атомами компонента – растворителя. Обычно растворы такого типа образуются между металлами и неметаллами, например, Fe-(C, N2, H2).

При известных условиях атомы растворенного элемента занимают определенные места в узлах решетки, т.е. от неупорядоченного расположения переходят в упорядоченное. Такие растворы называются упорядоченными твердыми растворами и являются промежуточными фазами между химическими соединениями и твердыми растворами.
Лекция 4
ДИАГРАММЫ СОСТОЯНИЯ
1. Понятие о диаграмме состояния (ДС).
2. Принцип построения ДС.
3. ДС для сплавов, образующих механические смеси (1 тип).
4. Анализ ДС двойных сплавов. Правило фаз. Правило отрезков.
5. ДС для сплавов П типа (с неограниченной растворимостью компонентов в твердом состоянии).
6. ДС для сплавов Ш типа (с ограниченной растворимостью в твердом состоянии).
7. Связь между свойствами сплава и типом ДС. Правило Курнакова.
Диаграмма состояния – это графическое изображение изменения фазового состава сплава в зависимости от температуры и концентрации. Строят их для условий, близких к равновесным. Давление принимается постоянное: Р=1АТМ=0,1Мпа (СИ).
Диаграммы позволяют судить об устойчивых состояниях сплавов, т.е. при условии минимальной свободной энергии Z.
Однако чаще всего сплавы находятся в метастабильном состоянии, т.е. обладают ограниченной устойчивостью. Под влиянием внешних факторов они переходят в более устойчивые состояния, т.к. их свободная энергия больше минимальной.
Метастабильные состояния сообщают сплавам высокие механические свойства, обеспечивают оптимальный комплекс свойств. Чтобы установить природу метастабильных состояний и разработать режимы термической или какой-либо другой обработки, позволяющей получить эти неравновесные состояния, необходимо знание диаграмм фазового равновесия.
Если в системе 2 компонента, диаграмму состояния строят в 2-х измерениях (температура-концентрация). По оси ординат откладывают температуру, по оси абсцисс – концентрацию.

Общее содержание компонентов в сплаве равно 100% и любая точка на оси абсцисс соответствует определенному содержанию каждого компонента. В т. С 40% В и 60%А, в т. Д – 60%В и 40%А. По мере удаления от т. А увеличивается количество компонента В и в т. В его будет 100%. Таким образом, крайние точки соответствуют чистым компонентам, а между ними – двойным сплавам.
Для сплавов, состоящих из 3-х и более компонентов, строят пространственные диаграммы (например, для 3-х компонентной – 2 оси концентрационные и одна температурная).
Каждая точка на ДС показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль – изменение температуры определенного сплава. Вид ДС зависит от типа взаимодействияч компонентов (раствор, химические соединения и т.д.).
ДС строят на основе экспериментальных данных. Сначала на основе термического анализа получают кривые охлаждения и по остановкам и перегибам, вызванным тепловым эффектом превращений, определяют температуру превращения.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 4467; Нарушение авторских прав?; Мы поможем в написании вашей работы!