
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квазистатические и нестатические процессы
|
|
|
|
Политропические процессы
Адиабатический процесс
Теплоемкость идеального газа. Применение первого начала термодинамики к различным процессам.
ТЕРМОДИНАМИКА
Лекция 6
КУРС Обзорные лекции
| ДАТА | ВРЕМЯ | ДИСЦИПЛИНА | № каб. | Преподаватель |
| 28 апреля четверг | 12.30-15.20 | Обзорные лекции. Управление персоналом | Кашпурова Н. П. | |
| 29 апреля пятница | 9.00-13.20 | Обзорные лекции. Управление персоналом | Кашпурова Н. П. | |
| 30 апреля суббота | 12.30-15.20 | Обзорные лекции. Основы менеджмента | Кашпурова О. В. | |
| 1 мая воскресенье | 12.30-16.50 | Обзорные лекции. Основы менеджмента | Кашпурова О. В. | |
| 2 мая понедельник | 9.00-11.50 | Обзорные лекции. Маркетинг | Кашпурова О. В. | |
| 3 мая вторник | 9.00-13.20 | Обзорные лекции. Маркетинг | Кашпурова О. В. |
Вопросы:
Термодинамика.
3.1. Квазистатические и нестатические процессы.
3.2. Гипотеза о равнораспределении энергии по степеням свободы
3.3. Внутренняя энергия системы.
3.4. Работа и теплота.
3.5. Полное изменение энергии равновесной системы. Первое начало термодинамики.
3.6. Работа, совершаемая макросистемой.
Термодинамика явилась первой наукой, на основе которой стало возможным статистическое изучение макросвойств и процессов для произвольных систем с числом частиц N>>1.
При термодинамическом подходе о макросвойствах системы судят на основе обобщенных исследований. К числу этих исследований относятся изучения:
1) процессов взаимопревращения теплоты и работы;
2) обратимых и необратимых процессов;
3) процессов при низких температурах.
Аналитическое обобщение такого рода опытов позволяет сформулировать три закона термодинамики, которые можно записать в виде дифференциальных уравнений и которые составляют его фундамент. Такой метод исследования называют феноменологическим. Он присущ и другим разделам физики (механика, электростатика и др.). При феноменологическом подходе полностью используются молекулярно-кинетические представления, поэтому выводы, полученные в этих рамках, не позволяют глубоко вскрыть природу изучаемых явлений. Оставаясь в рамках термодинамики невозможно обосновать законы термодинамики. Это свидетельствует об ограниченности феноменологического подхода. Эти законы термодинамики можно лишь обосновать на основе статистического метода.
|
|
|
Процессы, при которых макроскопическая система все время находится в равновесии (или точнее, в ходе которых система проходит через последовательный ряд равновесных состоянии) называется равновесным или квазистатическими .
Состояние считается равновесным, если во всех точках системы параметры состояния (p,V,T) одинаковы.
Если какой - либо параметр состояния системы в её различных точках неодинаковы, то состояние является неравновесным. Если такую систему предоставить самой себе, то параметр выровняется, и система придет в состояние равновесия.
Квазистатический процесс легко представить, если реальная скорость процесса 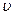 много меньше скорости восстановления равновесия. В этом случае при реальных изменениях с малой скоростью равновесие восстанавливается с большой скоростью, и при реальном изменении состояния макроскопической системы эта система проходит через ряд равновесных состояний.
много меньше скорости восстановления равновесия. В этом случае при реальных изменениях с малой скоростью равновесие восстанавливается с большой скоростью, и при реальном изменении состояния макроскопической системы эта система проходит через ряд равновесных состояний.
Рассмотрим макроскопическую систему А, взаимодействующую с термостатом В.
Будем считать
- давление макроскопической системы А равным р,
-давление термостата (р+  ).
).
1) Тогда за счет бесконечно малого перепада давление  начинается процесс выравнивания давления - система А начинает сжиматься. Если бы переход давления был равен нулю, то процесс отсутствовал бы, и его скорость была бы равна нулю.
начинается процесс выравнивания давления - система А начинает сжиматься. Если бы переход давления был равен нулю, то процесс отсутствовал бы, и его скорость была бы равна нулю.
|
|
|
2) При бесконечно малом перепаде  скорость процесс бесконечно мала, а скорость
скорость процесс бесконечно мала, а скорость  процесса восстановленного равновесия в газе конечна, т.е.
процесса восстановленного равновесия в газе конечна, т.е.  , и процесс сжатия газа будет проходить через последовательность равновесных состояний, т.е. квазистатически.
, и процесс сжатия газа будет проходить через последовательность равновесных состояний, т.е. квазистатически.
Такой процесс называют обратимым, т.к. достаточно бесконечно малых условий, и процесс потечет в обратном направлении, то есть если давление газа будет p + , а термостата р, то газ будет расширяться, проходя квазистатически через те же состояния, но в обратном порядке.
, а термостата р, то газ будет расширяться, проходя квазистатически через те же состояния, но в обратном порядке.
В термодинамике обратимыми процессами называют такие процессы, которые могут протекать как в прямом, так в обратном направлениях без заметных (конечных) изменений в окружающей среде.
3) Если же скорость протекания процесса много больше скорости восстановления равновесия,  , то процесс называется нестатическим или неравновесным.
, то процесс называется нестатическим или неравновесным.
В этом случае система проходит ряд неравновесных состояний. Физически такая ситуация встречается тогда, когда имеет место конечный перепад (градиент) параметров системы А и термостата В. Такие процессы называют еще необратимыми, т.к. бесконечно малых изменений условий в конечном состоянии будет недостаточно, чтобы вернуть систему в исходное состояние, т.е. процесс нельзя обратить без конечных изменений в окружающей среде.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1986; Нарушение авторских прав?; Мы поможем в написании вашей работы!