
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия идеального газа
|
|
|
|
Пусть начальное и конечное состояния, 1 и 2, газа определяются параметрами 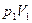 и
и 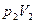 .
.
Согласно (3) элементарное приращение энтропии газа с учетом того, что dU=C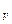 dT и pV = νRT, определяется как
dT и pV = νRT, определяется как
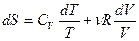 . (4)
. (4)
Взяв дифференциал логарифма от vRT = pV получим
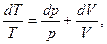 (5)
(5)
и формуле (4) можно придать симметричный вид:
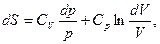
где учтено, что 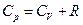
Проинтегрировав последнее выражение, получим

3. Приращение энтропии при необратимом процессе между двумя равновесными состояниями 1 и. 2. Непосредственно считать энтропию по необратимому процессу совершенно невозможно. Но энтропия — функция состояния. Этим мы и воспользуемся, проведя между состояниями 1 и 2 какой-нибудь обратимый процесс, ничего общего не имеющий с реальным необратимым процессом. Обычно выбирают такой обратимый процесс, по которому расчет проще.
4. Возрастание энтропии при смешении газов.
Пусть в двух половинах теплоизолированного сосуда объемом V находятся два идеальных газа, 1 и 2, разделенных перегородкой.
Температура, давление и количество вещества в обеих половинах одинаково.
После удаления перегородки начинается необратимый процесс смешения газов, в результате которого система приходит в равновесное состояние, в котором оба газа равномерно перемешаны.
Температура в конечном состоянии окажется прежней, так как газы идеальные и система теплоизолирована.
При 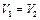 приращение энтропии каждого газа равно
приращение энтропии каждого газа равно 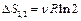 ,
,
и суммарное приращение энтропии системы 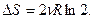
Приращение 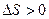 , так как процесс необратимый (обратный процесс самопроизвольного разделения газов невероятен).
, так как процесс необратимый (обратный процесс самопроизвольного разделения газов невероятен).
Последняя формула приводит к парадоксу Гиббса. Допустим, газы 1 и 2 тождественны. Тогда после снятия перегородки энтропия увеличивается, хотя конечное состояние ничем не отличается от начального. Для понимания описанной ситуации существенно заметить, что формула получена только для случая, когда газы различны. Для тождественных газов 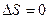 .
.
Таким образом, формула 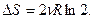 справедлива только при смешивании различных газов, хотя бы это различие было сколь угодно малым.
справедлива только при смешивании различных газов, хотя бы это различие было сколь угодно малым.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!