
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пептидний зв’язок
|
|
|
|
ПЛАН
Тема 6. Білки харчових продуктів
1. Фізіологічна роль білків для організму людини. Вміст білків у харчових продуктах.
2. Амінокислотний склад і структура білків.
3. Основні властивості білків, що проявляються при переробці, зберіганні та використанні харчових продуктів.
4. Класифікація білків.
Білками або протеїнами називають високомолекулярні природні полімери, молекули яких побудовані із залишків амінокислот. Кількість останніх значно коливається і іноді досягає декількох тисяч. Білки становлять близько 20% маси тіла людини і більше 50% сухої маси клітин.
Основні функції, які виконують білки в організмі людини:
- пластична функція, оскільки білки входять до складу всіх органів клітини;
- опорна функція: білки входять до складу кісткової тканини, хрящів;
- рухова функція: скорочення м'язів забезпечують білки актин і міозин;
- захисна функція білків обумовлена тим, що антитіла, які утворюються в організмі під час вторгнення в нього чужорідних тіл, є протеїнами;
- антитоксична функція білків пов'язана з тим, що вони здатні утворювати з токсичними речовинами малоактивні комплекси, які виводяться з організму людини;
- білки (протромбін) бере участь у процесах згортання крові, тим самим попереджає крововтрати під час травм, операцій;
- каталітична функція білків обумовлена тим, що всі ферменти за своєю природою – білки;
- транспортна функція (гемоглобін здійснює транспорт кисню, поживних речовин і продуктів обміну речовин в організмі);
- регуляторна функція білків полягає в тому, що багато гормонів і їх похідні – це протеїни. Білки їжі впливають на процеси збудження і гальмування в корі головного мозку;
- енергетична функція (білки їжі – це джерело енергії для організму людини). У результаті окислення 1 г білка утворюється 16,7 кДж енергії.
Людині на добу потрібно 80-100 г білків, з яких 40-50 г мають бути тваринними білками. Підвищена кількість білкової їжі потрібна робітникам важкої фізичної праці і молодому організму в період росту.
У м'ясі міститься 14-20,5% білків, у рибі - 13- 18, у кисломолочному сирі - 16,1, у сирі - 22-29, у яйцях - 12,5, у хлібі 6-10,3, у крупах - 7,6-14,9, у зернобобових – 23-34, у картоплі - 2, у плодах і овочах - 0,5-6,5 %.
Засвоюваність білків картоплі становить 70, білків крупів і обійного борошна - 70, білків овочів -80, білків фруктів, ягід і горіхів - 85, білків макаронів, борошна, хліба, рису - 85, білків м'яса, риби - 95, білків молока, молочних продуктів і яєць - 96 %. Біологічну цінність продукту характеризує якість його білкових компонентів, позв'язаних як з переварюваністю білка, так і зі ступенем збалансованості його амінокислотного складу.
У організмі людини під впливом протеолітичних ферментів білки їжі розщеплюються на амінокислоти, з яких синтезуються білки, необхідні для побудови тканин організму.
Із 20 амінокислот, що утворюються в результаті розщеплення білків, для побудови тканин організму людини щодня потрібно вісім незамінних: триптофан - 1, лізин - 3,2-4,6, фенілаланін - 2-4, лейцин - 4,7, ізолейцин - 2,9-4, метіонін - 2,2-3,5, валін - 3,2-4,2, треонін – 2-2,7 г; інші амінокислоти можуть замінюватися і синтезуватися.
Амінокислоти аргінін і гістидин вважаються умовно незамінними: їх синтез в організмі не завжди повністю забезпечує його потреби. Для характеристики біологічної цінності білка визначають загальний вміст амінокислот.
Добова потреба в замінних амінокислотах: аргінін - 6 г, гістидин - 2, цистин – 2-3, тирозин – 3-4, аланін - 3, серин - 3, глютамінова кислота - 16, аспарагинова кислота - 6, пролін - 5, глікокол - 3 г.
Будь-яка амінокислота у своєму складі має дві функціональні групи: карбоксильну СООН і аміногрупу (NН2). Окрім цього, амінокислоти можуть містити гідроксидні групи, ароматичні кільця, сульфгідрильні групи й ін. До складу молекули білка входять сотні, а іноді і тисячі залишків амінокислот, тому молекулярна маса, наприклад, молочного білка казеїну 30000, а деяких білків 10 млн.
Продукт з'єднання амінокислот називають пептидом, який утворюється за рахунок пептидного зв'язку – результату взаємодії карбоксильної групи однієї амінокислоти і аміногрупи іншої амінокислоти.Залежно від кількості залишків амінокислот, які створюють пептиди, розрізняють дипептиди, трипептиди і т.д.
Продукти з'єднання багатьох амінокислот називаються поліпептидами. Білок можна розглядати як високомолекулярний поліпептид, який має чотири рівні організації – первинну, вторинну, третинну, четвертинну.


 NН2 – СН – СООН + НNН – СН – СООН
NН2 – СН – СООН + НNН – СН – СООН
R R1




 NН2 – СН – СО – NН – СН – СООН
NН2 – СН – СО – NН – СН – СООН
R R1
Первинна структура – певна послідовність залишків амінокислот у поліпептидному ланцюзі молекул білка. Знаючи первинну структуру білка, можна написати повний його елементний склад.
Вторинна структура – просторова конфігурація поліпептидного ланцюга, який може існувати у вигляді 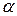 -спіралі,
-спіралі, 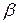 - складчастої структури.
- складчастої структури.
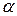 -спіраль найчастіше закручена за годинниковою стрілкою і характеризується такими показниками: один виток
-спіраль найчастіше закручена за годинниковою стрілкою і характеризується такими показниками: один виток 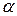 -спіралі складається з 3,6 залишків амінокислот. Радіус спіралі приблизно 1 нм.
-спіралі складається з 3,6 залишків амінокислот. Радіус спіралі приблизно 1 нм.
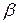 - складчаста структура – це структура, за якою поліпептидні ланцюги складаються в пачки.
- складчаста структура – це структура, за якою поліпептидні ланцюги складаються в пачки.
Третинна структура характеризує просторове розташування поліпептидного ланцюга. Третинна структура має пряме відношення до форми молекул білка, яка може бути від кулястої до ниткоподібної.
Чвертинна структура характерна тільки для тих білків, молекули яких складаються з двох, чотирьох і більше поліпептидних ланцюгів, функціонуючих як єдине ціле. Білки із чвертинною структурою проявляють високу біологічну активність, наприклад, міоглобін, гемоглобін.
Під впливом технологічних процесів під час виробництва харчових продуктів, їх зберігання, руху товару білки здатні зазнавати значних змін, які впливають на харчову цінність, смакові і ароматичні властивості і на терміни зберігання продовольчих товарів. Харчова цінність білків обумовлена тим, що вони є джерелом енергії і біологічно цінних речовин – незамінних амінокислот і ферментів. Білки, що входять до складу харчових продуктів, можуть бути причиною небажаних процесів під час зберігання – гідролізу, гниття. Наявність у деяких продовольчих товарах білків погіршує їхні смакові й ароматичні властивості (чай, тютюн). За глибокого гідролітичного розпаду білків утворюються амінокислоти, деякі з яких мають солодкий (L-аланін) або гіркий смак (L-триптофан), який додає харчовим продуктам небажаного смаку. Для об'єктивної оцінки споживних властивостей харчових продуктів необхідно знати властивості білків.
Найважливішими властивостями білків, які виявляються під час виробництва, зберігання і використання продовольчих товарів, є амфотерність, гідрофільність, старіння, денатурація, піноутворення, гідроліз, меланоїдиноутворення, утворення ліпопротеїнів, гниття.
Амфотерність білків, що складаються з амінокислот, обумовлена наявністю в молекулі амінокислоти двох функціональних груп: аміногрупи і карбоксильної групи. Білки у водних розчинах можуть дисоціювати і як кислоти, і як луги. Завдяки цим властивостям кожна молекула білка має свою ізоелектричну точку (ІЕТ) -значення рН середовища, за якого заряд білкової молекули рівний нулю. Білки в цій точці електронейтральні, а їхня в'язкість і розчинність є якнайменшою. Ізоелектрична точка для різних білків різна: яєчного білка альбуміну - 4,8; казеїну молока – 4,6; білка пшеничного зерна гліадину – 7,1. Ця властивість білків дозволяє цілеспрямовано вести технологічні процеси у ряді харчових галузей: при виробництві сиру необхідно провести денатурацію білка молока казеїну (ІЕТ - 4,6), для цього знижують рН молока молочною кислотою, що утворилася в результаті молочнокислого бродіння; у виробництві згущеного молока технологічний процес ведуть, зберігаючи дисперсність білків, для цього не допускають зниження рН.
Гідрофільність. Багато білків належать до гідрофільних сполук, завдяки чому мають здатність до набухання. Таку взаємодію називають гідратацією. Під час гідратації навколо кожної молекули білка утворюються водні оболонки, що складаються з молекул води, орієнтованих у просторі певним чином. За додавання речовин (спирт, ацетон, нейтральні солі лужних металів і багато інших речовин), що руйнують водні оболонки, білки випадають в осад. У результаті гідратації об'єм молекули білка збільшується, але він завжди буде меншим суми первинного об'єму білка і води, які беруть участь в їх взаємодії.
Гідрофільні властивості білків мають велике значення в харчовій промисловості. Різна гідрофільність білків клейковини — одна з ознак, що характеризують якість зерна пшениці і одержуваного з нього борошна (так звані сильні і слабкі пшениці). Тісто, яке одержують в хлібопекарському виробництві для виготовлення борошняних кондитерських виробів є набряклим у воді білком, концентрованим холодцем, який містить зерна крохмалю.
За тривалого зберігання продуктів здатність білків до набухання знижується внаслідок втрати ними гідрофільних властивостей. Цей процес називається «старінням» білків. Продукти, які тривалий час зберігалися і які містять значну кількість білків (боби, сушена риба і ін.) стають жорсткими і вимагають більше часу на варіння до готовності.
Денатурація. Денатурація білків – руйнування просторової структури білка, що приводить до зміни його основних властивостей. Це складний процес, за якого під впливом зовнішніх чинників – механічної дії, температури, дії хімічних речовин, УФ-променів, ультразвуку і інших чинників – відбувається зміна вторинної, третинної і четвертинної структури білкової макромолекули. Первинна структура, а отже, і елементний склад білка не змінюється. Суть процесу денатурації білків зводиться до втрати ними гідрофільних і набуття гідрофобних властивостей.
За денатурації змінюються властивості білка:
- міняється форма білкової макромолекули, відбувається агрегація;
- знижується розчинність, здатність до гідратації;
- втрачається біологічна активність;
- збільшується в'язкість;
- полегшується дія на білки протеолітичних ферментів, (денатурований білок легше засвоюється).
Властивість білків денатуруватись використовується в харчових виробництвах – у процесі при випічки хліба і кондитерських виробів, сушіння макаронів, овочів, плодів, молока, риби, грибів і ін.
Більшість тваринних білків денатурує за температури 45-50°С, а в дуже кислому середовищі (рН нижче 4) і дуже лужному (рН більше 10) всі харчові білки денатурують при 37°С. За термічної денатурації порушуються водневі зв'язки і втрачаються гідрофільні властивості, руйнуються ферменти, у зв'язку із чим продукти не піддаються автолізу.
Денатурацію білків може викликати зміна рН середовища. Наприклад, така денатурація відбувається у процесі виробництва кисломолочних продуктів, сичужних сирів, при консервуванні із застосуванням оцтової або лимонної кислот.
Денатурація білків відбувається за допомогою дії деяких органічних речовин (алкалоїдів, сечовини, фенолів й ін.). Цей вид денатурації використовується у виробництві вин, пива для отримання продукту високої якості: в результаті денатурації білків при обробці цих напоїв дубильними речовинами вина, пиво стають прозорими і не мають осаду.
Піноутворення. Піноутворення - це здатність білків утворювати висококонцентровані системи „рідина – газ”. Такі системи називаються пінами. Білки як піноутворювачі широко використовуються в кондитерській промисловості (пастила, зефір, суфле). Структуру піни має хліб, і це впливає на його органолептичні властивості.
Гідроліз. Гідроліз білків у харчових продуктах каталізується ферментами. Цей процес приводить до руйнування первинної структури білка. Під впливом протеаз - ферментів, що каталізують гідролітичне розщеплювання білків, останні розпадаються на простіші продукти (поліпептиди і діпептиди) і зрештою на амінокислоти. Швидкість гідролізу білка залежить від його складу, молекулярної структури, активності фермента і умов. Частковий гідроліз білка відбувається в тісті, ряді м'ясних і молочних продуктів. Під час зберігання продовольчих товарів гідроліз білків приводить до погіршення якості м'яса, риби, сирів і т.д.
Під час зберігання харчових продуктів білки піддаються змінам, особливо ті з них, які є в продуктах з високим вмістом води і які зберігаються в умовах підвищеної підвищеній температури та і інших несприятливих умовах. До таких змін відносять процеси неферментативного потемніння і гниття.
Неферментативне потемніння харчових продуктів відбувається в результаті меланоїдиноутворення (див. гл. Вуглеводи) і взаємодії продуктів окислення ліпідів з білками з утворенням коричневих пігментів — ліпопротеїнів. У цій реакції беруть активну участь окислені жирні кислоти і амінокислоти (лізин, гістидин, тирозин, аргінін, метіонін).
Ліпопротеїни і меланоїдіни знижують біологічну і харчову цінність продуктів харчування.
Гниття – це глибокий розпад білків під дією гнильних бактерій і інших мікроорганізмів з виділенням пептидів, які руйнуються з утворенням більш простих сполук — амінів, жирних кислот, спиртів, фенолів, індолу, скатолу, меркаптану, сірководню і ін. Ці речовини надають продуктам неприємного запаху, змінюють їх консистенцію, колір і інші властивості. Деякі сполуки, що утворюються в результаті глибокого розпаду білків, є сильними отрутами. Органічні речовини, які утворюються під час гниття білків м'яса, одержали назву птомаїнів або трупних отрут. Харчові продукти, білки яких почали гнити, небезпечні для здоров'я людини.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2715; Нарушение авторских прав?; Мы поможем в написании вашей работы!