
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый и второй законы тепмодинамики
|
|
|
|
Термодинамика взрывных процессов.
Все исследования детонационных характеристик взрывчатых систем в прикладном плане сводятся, по существу, к решению трех основных проблем:
· определение теплоты взрыва, удельного объема и состава продуктов
взрывчатого превращения;
· расчет давлений р1 и рн в плоскостях химического пика и Чепмена - Жуге соответственно, закономерностей их изменения в зоне химических
реакций и при последующем изоэнтропийном расширении;
· отыскание возможностей прогнозирования детонационных свойств
вновь синтезируемых взрывчатых соединений и их смесей.
Первая проблема связана с оценкой фугасного действия взрыва в воздухе и плотных средах, а также с решением вопроса о допустимости применения различных ВВ при буровзрывных работах с точки зрения безвредности продуктов взрыва для человеческого организма. Знание амплитудных значений и градиентов давления в зоне химических реакций и за ее пределами необходимо для предсказания результатов местного (пробивного, метательного, кумулятивного и т. п.) действия взрыва. Важность третьей проблемы очевидна.
Строгое решение перечисленных вопросов должно базироваться на учете законов гидродинамики, газовой динамики, термохимии и химической кинетики.
Остановимся прежде всего на термодинамических характеристиках ВВ.
Фундаментальными характеристиками любой термодинамической системы являются внутренняя энергия Е, энтальпия i и энтропия S.
Внутренняя энергия характеризует общий запас энергии системы, включая энергию поступательного, колебательного и вращательного движения молекул и атомов, а также энергию электронов и атомных ядер. Важно подчеркнуть, что внутренняя энергия не учитывает кинетическую энергию движения системы в целом и потенциальную энергию ее положения; иными словами, внутренняя энергия замкнутой термодинамической системы изменяется при сообщении ей той или иной скорости или при перемещенее в гравитационном поле.
При переходе системы из любого начального состояния 1 в любое конечное состояние 2 изменение внутренней энергии ΔЕ = Е2 — Е1 всегда одно и то же, вне зависимости от пути и способа перехода, что непосредственно вытекает из закона сохранения энергии. Следовательно, внутренняя энергия есть однозначная функция состояния (параметр состояния) системы, а ее конечно малое приращение dE является полным дифференциалом от переменных состояния (давления р, удельного объема v и температуры Т).
Энтальпия (называемая также теплосодержанием или тепловой функцией Гиббса) связана с внутренней энергией соотношением
i = Е + pv. (1.1)
Энтальпия, так же как и внутренняя энергия, является однозначной функцией состояния системы.
Абсолютные значения энтальпии и внутренней энергии рассчитать или измерить невозможно, однако при термодинамических расчетах вполне достаточно знать их приращения. На практике обычно пользуются табличными значениями i и Е, определенными таким образом, что одно из состояний вещества или смеси принимается стандартным. Под стандартными условиями обычно подразумевают давление, равное одной физической атмосфере (760 мм рт. ст.), и одну из температур: 0 °К, 0° С, 18 °С, 293,15 °К или 298,15 °К. В зависимости от выбора стандартной температуры, говорят о той или иной системе отсчета. Наиболее употребительными системами отсчета в настоящее время являются:
а) р0 = 1 атм, Т0 = 293,15 °К; б) р„ = 1 атм Т0 = 298,15 °К.
Энтропия. В отличие от внутренней энергии и энтальпии, абсолютное значение энтропии можно рассчитать, поскольку при 0 °К теплоемкость и энтропия чистого вещества в кристаллическом состоянии равны нулю.
Первое начало термодинамики представляет собой приложение к термодинамическим системам общего закона сохранения и превращения энергии, согласно которому сумма всех видов энергии в замкнутой или изолированной системе является величиной постоянной.
Другими словами, первое начало термодинамики есть частный случай всеобщего закона сохранения и превращения энергии в применении к задачам, рассматриваемым в термодинамике, т. е. к процессам, сопровождающимся совершением работы и выделением, поглощением или, говоря более обще, преобразованием теплоты.
Первое начало термодинамики утверждает, что теплота может быть превращена в механическую работу или в другие виды энергии и, обратно, работа или всякая другая энергия может быть преобразована в теплоту, причем во всех случаях определенное количество теплоты эквивалентно определенному количеству работы.
Таким образом, между количеством теплоты Q и механической работой L, которая может быть получена за счет превращения теплоты в работу, имеется не зависящее от характера процесса соотношение

где А — тепловой эквивалент единицы работы, равный 1/426,45 ккал\кгм.
В последующих аналитических выводах, основываясь на эквивалентности взаимно превращающихся количеств теплоты и механической работы, мы будем предполагать, что как теплота, так и механическая работа измеряются в одних и тех же единицах, например в калориях, вследствие чего множитель А в уравнениях, содержащих L и Q одновременно, фигурировать не ■будет. Во второй части настоящего курса, где работа L обычно выражается в килограммометрах, а теплота — в килокалориях, коэффициент А будет вводиться в расчетные уравнения.
Если через Е обозначить полную энергию термодинамической системы независимо от тех конкретных форм, в которых эта энергия может существовать, то согласно закону сохранения и превращения энергии полная энергия замкнутой или изолированной термодинамической системы не изменяется с течением времени, т. е.
E = const,
или, что то же самое
Е2 — Е1=0,
Всякая термодинамическая система, в том числе каждое из тел в любом из состояний, обладает некоторой полной энергией Е, представляющей собой сумму кинетической энергии движения системы как целого Екин, потенциальной энергии Епот, обусловленной определенным положением системы как целого или ее макроскопических частей в каком-либо внешнем поле сил (например, в поле силы тяжести, в электрическом или магнитном поле и т. д.), и так называемой внутренней энергии U, которая не связана с движением всей системы как целого или с наличием внешнего силового поля и состоит из собственной энергии отдельных частей, составляющих рассматриваемую систему:
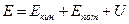
В том случае, когда система находится в состоянии равновесия, а внешнее поле сил отсутствует, полная энергия системы совпадает с ее внутренней энергией, т. е.

Согласно первому началу термодинамики количество полученного системой тепла dQ равно сумме приращений внутренней энергии системы dU и работы dL, произведенной системой, т. е.
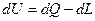 (1.2)
(1.2)
Это равенство справедливо как для обратимых, так и для необратимых процессов и представляет собой общее аналитическое выражение первого начала термодинамики для бесконечно малого процесса.
Если производимая системой работа связана только с изменением объема системы, т. е. равна

где р' есть внешнее давление (давление окружающей среды), то уравнение (1.2) может быть переписано в виде:
 (1.3)
(1.3)
Уравнение (1.3), так же как и уравнение (1.2), справедливо как для обратимых, так и для необратимых процессов.
В случае обратимых процессов внешнее давление р' строго равно давлению системы р, являющемуся функцией объема системы V и температуры ее Т и определяемому уравнением состояния
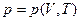
вследствие чего уравнение (2-17) может быть написано в виде:
 (1.4)
(1.4)
Уравнение (1.4) представляет собой аналитическое выражение первого начала термодинамики, когда в качестве независимых переменных или параметров, характеризующих состояние системы, взяты объем системы V и температура Т. Это уравнение связывает количество тепла dQ, поглощенного системой, изменение внутренней энергии dU и работу изменения объема р dV при обратимом бесконечно малом процессе изменения состояния системы.
Второе начало термодинамики указывает на особый характер происходящих в природе тепловых процессов, определяет направление, в котором протекают все реальные процессы, и устанавливает пределы возможных превращений тепла в работу.
Многочисленные опытные данные показывают, что все реальные макроскопические процессы являются необратимыми. Эта особенность реальных тепловых процессов обусловлена действием одного или нескольких из следующих факторов: теплообмена при конечной разности температур, трения, диффузии.
Даже те процессы, в которых изменение состояния тела происходит весьма медленно и которые мы ранее считали обратимыми, на самом деле являются, хотя бы и в очень малой степени, необратимыми.
Реальные тепловые процессы в отличие от идеальных процессов, которые могут протекать в двух прямо противоположных направлениях, непосредственно обращены быть не могут и являются всегда необратимыми. Необратимость тепловых процессов и находит свое выражение во втором начале термодинамики.
Второе начало термодинамики коренным образом отличается от первого начала. Первое начало термодинамики совершенно не рассматривает вопроса о направлении тепловых процессов. С точки зрения первого начала термодинамики любой мыслимый процесс, который не противоречит закону сохранения энергии, принципиально возможен и мог бы иметь место в природе.
Так, например, основываясь только на первом начале термодинамики, можно было бы предположить, что при теплообмене между двумя телами раз. личной температуры тепло может переходить как от тела с большей темпе ратурой к телу с меньшей температурой, так и, наоборот, от тела с меньшей температурой к телу с большей температурой. Единственное ограничение, налагаемое первым началом термодинамики на этот процесс, заключается в требовании равенства количеств тепла, отданного первым и полученного вторым телом (при условии отсутствия работы).
ратурой к телу с меньшей температурой, так и, наоборот, от тела с меньшей температурой к телу с большей температурой. Единственное ограничение, налагаемое первым началом термодинамики на этот процесс, заключается в требовании равенства количеств тепла, отданного первым и полученного вторым телом (при условии отсутствия работы).
Как видно из сказанного, первое начало термодинамики не дает никаких указаний о том, в каком направлении происходит в действительности переход тепла.
Ответ на вопрос о направлении, в котором действительно происходит переход тепла между двумя телами и в других более сложных случаях, дает второе начало термодинамики, из которого вытекает, что тепло само собой переходит лишь от тела с более высокой температурой к телу с более низкой температурой, но никогда наоборот.
Из этого утверждения, которое можно рассматривать как одну из формулировок второго начала термодинамики, следует, что никакими способами, никаким воздействием других тел (или механизмов) невозможно заставить тепло переходить от менее нагретого тела к более нагретому и притом так, чтобы все эти другие тела, действующие в процессе, по окончании процесса возвратились к своему первоначальному состоянию (например, без затраты работы). Наоборот, от более нагретого тела к менее нагретому тепло может переходить само собой, т. е. если даже в этом процессе и участвовали какие-либо другие тела, то по окончании процесса эти тела могут возвратиться в свое первоначальное состояние.
Из рассмотрения системы тел, имеющих одинаковые температуры, следует, что с помощью подобной системы нельзя создать такой непрерывно действующий тепловой двигатель, который производил бы положительную работу за счет энергии находящихся в тепловом равновесии тел или, что то же самое, за счет отнятия тепла или охлаждения одного единственного источника теплоты (которым является в рассматриваемом случае совокупность всех тел одинаковой температуры).
Изучение любых, сколь угодно сложных систем показывает, что вообще невозможно осуществить такой периодически действующий двигатель, в результате действия которого производилась бы положительная работа только за счет охлаждения одного тела без того, чтобы в системе или окружающих телах не произошли одновременно какие либо другие изменения.
Этот наиболее общий вывод, характеризующий свойства тепловых двигателей, составляет содержание второго начала термодинамики и может рассматриваться как вторая формулировка второго начала термодинамики. Ясно, что эта формулировка вполне эквивалентна приведенной ранее первой формулировке второго начала.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!