
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия молекулы
|
|
|
|
Молекулы состоят из одинаковых или различных атомов, соединенных между собой в одно целое силами связи, которые называют химическими связями. Силы, удерживающие атомы в молекуле, вызваны взаимодействием внешних электронов.
Различают два вида связи. Один из них осуществляется в тех молекулах, в которых часть внешних электронов движется вокруг обоих ядер (мы ограничимся рассмотрением только двухатомных молекул). Такая связь называется гомеополярной или ковалентной связью. К молекулам с такой связью относятся молекулы с одинаковыми ядрами (Н2, N2, O2) и молекулы с разными ядрами (например, CN).
Второй тип связи имеет место в том случае, когда электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а около другого – их недостаток. Таким образом, молекула как бы состоит из двух ионов противоположных знаков, притягивающихся друг к другу. Этот тип связи называется гетерополярной или ионной. Примером молекул с ионной связью могут служить NaCl, KBr, HCl и т. д.
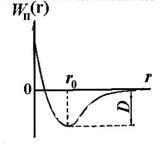
Независимо от природы тех сил, которые приводят к образованию устойчивой системы из двух атомов можно высказать некоторые общие соображения о характере этих сил. Атомы, расположенные на значительном расстоянии друг от друга, не взаимодействуют дуг с другом. По мере уменьшения расстояния r между ядрами атомов возрастают силы взаимного притяжения, действующие между атомами (см. рис. 11.5, F 2). Однако эти силы не являются единственными. На малых расстояниях между атомами проявляют свое действие силы взаимного отталкивания F 1, не позволяющие электронам одного атома слишком глубоко проникнуть внутрь электронных оболочек другого атома. Силы отталкивания являются более короткодействующими, чем силы притяжения. Благодаря одновременному действию противоположено направленных сил – притяжения и отталкивания – на некотором расстоянии r0 между атомами обе силы уравновешивают друг друга и их геометрическая сумма (результирующая сила F) равна нулю.
|
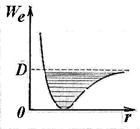
 Этому расстоянию соответствует наименьшая взаимная потенциальная энергия W п(r) атомов двухатомной молекулы. На рис. 11.6 приведена кривая зависимости от r потенциальной энергии W п(r) взаимодействия двух атомов в молекуле. Равновесное междуатомное расстояние r 0 в молекуле называют длиной связи. Величина D (на кривой рис. 11.6) определяет энергию связи молекулы. Она численно равна работе, которую надо совершить для того, чтобы разорвать связи атомов в молекуле.
Этому расстоянию соответствует наименьшая взаимная потенциальная энергия W п(r) атомов двухатомной молекулы. На рис. 11.6 приведена кривая зависимости от r потенциальной энергии W п(r) взаимодействия двух атомов в молекуле. Равновесное междуатомное расстояние r 0 в молекуле называют длиной связи. Величина D (на кривой рис. 11.6) определяет энергию связи молекулы. Она численно равна работе, которую надо совершить для того, чтобы разорвать связи атомов в молекуле.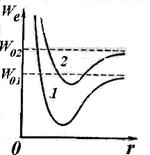
|
W = W e + W v + W r, (11.4)
|
Используя уравнения квантовой механики, можно показать, что не только при изменении электронной конфигурации, но и при изменении энергии колебательного и вращательного движений, энергия указанных видов движения имеет дискретные значения и может быть выражены следующим образом:
 (11.5)и
(11.5)и 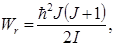 (11.6)
(11.6)
 где v – колебательное квантовое число, которое может принимать следующие значения:
где v – колебательное квантовое число, которое может принимать следующие значения:
v = 0, 1, 2, 3, …; ωv – циклическая частота колебаний; J – вращательное квантовое число, которое может принимать следующие значения: J = 0, 1, 2, 3, …; I – момент инерции молекулы относительно оси, проходящий через центр инерции.
|
Итак, в соответствии с (11.5)и (11.6)полнаяэнергия молекулы равна:

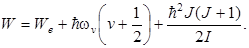
Опыт и теория показывают, что расстояние между вращательными уровнями ∆ W r значительно меньше расстояния между колебательными уровнями ∆ W v, которое в свою очередь значительно меньше, чем расстояние между электронными уровнями ∆ W е. Таким образом, схема энергетических уровней молекулы выглядит так, как показано на рис.11.9 (приведены только два электронных уровня). Совокупность уровней содержится в правом столбце рисунка. Первые два столбца лишь поясняют возникновение уровней.
|
молекулярные же спектры состоят из полос, резких с одного края и размытых с другого. При изучении этих спектров с помощью приборов с большой разрешающей способностью определяют важнейшие физические характеристики молекул: длину связи, энергию связи, момент инерции.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 493; Нарушение авторских прав?; Мы поможем в написании вашей работы!