
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика р-элементов (р-блок)
|
|
|
|
Р-ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
 К р-блоку относят 30 элементов IIIА—VIIIА-групп периодической системы. р-Элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА—VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы).
К р-блоку относят 30 элементов IIIА—VIIIА-групп периодической системы. р-Элементы входят во второй и третий малые периоды, а также в четвертый — шестой большие периоды. У элементов IIIА-группы появляется первый электрон на р-орбитали. В других группах IVА—VIIIА происходит последовательное заполнение р-подуровня до 6 электронов (отсюда название р-элементы).
Строение внешних электронных оболочек атомов элементов р-блока (общая формула пs2npa, где а = 1-6).
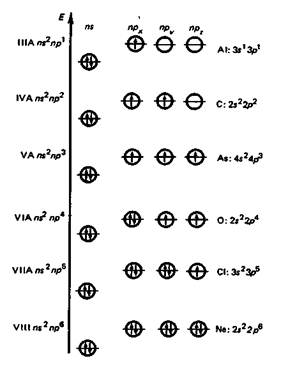 В периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются.
В периодах слева направо атомные и ионные радиусы р-элементов по мере увеличения заряда ядра уменьшаются, энергия ионизации и сродство к электрону в целом возрастают, электроотрицательность увеличивается, окислительная активность элементных веществ и неметаллические свойства усиливаются.
В группах радиусы атомов и однотипных ионов, в общем, увеличиваются. Энергия ионизации при переходе от 2р-элементов к 6р-элементам уменьшается, так как по мере возрастания числа электронных оболочек усиливается экранирование заряда ядер электронами, предшествующими внешним электронам.
С увеличением порядкового номера р-элемента в группе неметаллические свойства ослабевают, а металлические усиливаются.
На свойства р-элементов и их соединений оказывает влияние как появление новых подуровней на внешней электронной оболочке, так и заполнение подуровней внутренних электронных оболочек. р-Элементы второго периода — В, С, N, О, F — резко отличаются от элементов нижеследуюших периодов Так, начиная с р-элементов третьего периода, появляется низколежащий свободный d-подуровень, на который могут переводить электроны с р-подуровня при возбуждении атомов Полностью заполненный 3d-полуронень у d-элементов четвертого периода — Gа, Gе, Аs, Sе, Вr — обусловливает отличие их свойств от элементов третьего периода Максимальное заполнение 4f-подуровня в шестом периоде аналогично сказывается на различии свойств р-элементов шестого и пятого периода.
Вдоль периода у р-элементов падает способность к образованию положительно заряженных ионов с зарядом, отвечающим номеру группы. Наоборот, способность к образованию отрицательных ионов с зарядом, равным разности (8 — № группы), возрастает при движении вдоль периода.
 р-Элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы Э2 элементов второго периода — N2, О2 и F2. При переходе от IIIА- к IVА- и VА-группам устойчивость молекул возрастает, а затем при переходе к VIIIА-группе понижается. В группах при движении вниз прочность связи Э—Э уменьшается.
р-Элементы образуют двухатомные молекулы Э2, различающиеся по устойчивости. Наиболее устойчивы молекулы Э2 элементов второго периода — N2, О2 и F2. При переходе от IIIА- к IVА- и VА-группам устойчивость молекул возрастает, а затем при переходе к VIIIА-группе понижается. В группах при движении вниз прочность связи Э—Э уменьшается.
р-Элементы второго периода — азот, кислород и фтор — обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующих периодов эту способность теряют.
Сходство р-элементов второго периода с р-элементами последующих периодов заключается в основном только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот сильно отличаются от остальных элементов своих групп (наличие d - и f-подуровней).
При переходе от р-элементов второго периода к р-элементам третьего и последующих периодов сохраняются все типы связей, характерные для элементов второго периода, и появляются новые типы химической связи. В этом направлении увеличивается склонность элементов образовывать комплексные соединения и повышаются координационные числа.
 Так, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12.
Так, если р-элементы второго периода имеют в соединениях координационные числа 2, 3, 4, то р-элементы последующих периодов могут иметь координационные числа 5, 6, 7, 8 и даже 12.
При переходе вниз по группе устойчивость максимальной положительной степени окисления у р-элементов уменьшается и возрастает устойчивость низших степеней окисления. Так, например, для углерода устойчивая степень окисления +4, а для свинца +2, для алюминия +3, а для таллия +1.
Физические свойства простых веществ р-элементов сильно различаются. Одни вещества — кислород, азот (газы) — кипят и плавятся при очень низких температурах, другие — бор, углерод — при очень высоких. По группам и периодам физические свойства изменяются немонотонно, и не всегда характер изменений легко связать со строением электронных оболочек атомов, типом химической связи, координационным числом атома.
Таким образом, у p-элементов различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s-элементов.
Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N. Р, О, S, Si, Сl) образуют многочисленные соединения между собой и с s-, d - и f-элементами. Большинство известных на Земле соединений — это соединения р-элементов.
Таким образом, изучение р-элементов особенно важно для медиков, так как пять из них — С, N. Р, О и S — являются органогенами и составляют основу живых систем, а ряд других — Р, Сl, I — незаменимые микроэлементы.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 563; Нарушение авторских прав?; Мы поможем в написании вашей работы!