
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика р-элементов VА-группы
|
|
|
|
Токсичность соединений элементов IVА-группы с ростом атомной массы элемента возрастает.
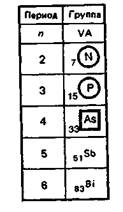 В VА-группу периодической системы Д.И. Менделеева входят азот, фосфор, мышьяк, сурьма, висмут.
В VА-группу периодической системы Д.И. Менделеева входят азот, фосфор, мышьяк, сурьма, висмут.
 Электронная формула валентной оболочки атомов элементов VА-группы:
Электронная формула валентной оболочки атомов элементов VА-группы:
Атомы этих элементов имеют по пять валентных электронов на s- и р-орбиталях внешнего энергетического уровня. Из них в невозбужденном состоянии атома неспарены три р-электрона.
 При возбуждении атомов происходит распаривание s-электронов и переход одного из них на d-подуровень (за исключением атома азота, внешние электроны которого не имеют низколежащего d-подуровня). Например, у атома фосфора в возбужденном состоянии электроны внешнего энергетического уровня приобретают конфигурацию 3s13р33d1.
При возбуждении атомов происходит распаривание s-электронов и переход одного из них на d-подуровень (за исключением атома азота, внешние электроны которого не имеют низколежащего d-подуровня). Например, у атома фосфора в возбужденном состоянии электроны внешнего энергетического уровня приобретают конфигурацию 3s13р33d1.
Соответственно, атомы элементов этой группы способны образовывать три и максимально пять ковалентных связей. Исключение составляет атом азота, который не может образовывать больше четырех ковалентных связей (три за счет неспаренных р-электронов и одну по донорно-акцепторному механизму за счет неподеленной пары электронов на 2s-подуровне).
В соединениях элементы этой группы проявляют степени окисления +1, +2, +3, +4, + 5, -3. Для азота наиболее характерны степени окисления +3, +5, —3, а также +2 и +4.
Для фосфора наиболее характерна степень окисления +5, реже имеет он в соединениях степени окисления +3 и —3. Степени окисления мышьяка, сурьмы и висмута равны +3, +5 и —3. Вследствие особой устойчивости электронной конфигурации 6s2 для висмута более характерна степень окисления +3.
В организме человека азот находится в биомолекулах: аминах, амидах, аминокислотах в степени окисления —3, фосфор — в виде солей и сложных эфиров ортофосфорной кислоты и полифосфорных кислот в степени окисления +5.
Как и в других группах р-элементов с ростом порядкового номера все большую роль в образовании химических связей у элементов VА-группы начинают играть d - (и даже f-) орбитали, поэтому значения устойчивых координационных чисел в ряду N—Р—Аs—Sb-—Вi возрастают. Так, если для азота максимальное координационное число равно 4 (sp3-гибридизация в ионе аммония NН4+), то для фосфора наряду с координационным числом 4 (sp3-гибридизация) характерны и координационные числа 5 (sp3d-гибридизация) и 6 (sp3d2-гибридизация).
 Для мышьяка, сурьмы и висмута более характерны координационные числа 5 и 6.
Для мышьяка, сурьмы и висмута более характерны координационные числа 5 и 6.
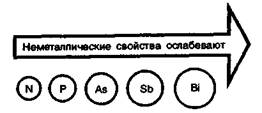 С увеличением радиусов атомов от азота к висмуту закономерно уменьшается энергия ионизации и относительная электроотрицательность. Этим обусловлено ослабление неметаллических свойств в ряду N—Р—Аs—Sb—Вi. Азот и фосфор — типичные неметаллы. Мышьяк амфотерен, хотя неметаллические, свойства сильнее выражены, чем металлические. Сурьма амфотерна, неметаллические и металлические свойства выражены примерно одинаково. Для висмута характерно преобладание металлических свойств.
С увеличением радиусов атомов от азота к висмуту закономерно уменьшается энергия ионизации и относительная электроотрицательность. Этим обусловлено ослабление неметаллических свойств в ряду N—Р—Аs—Sb—Вi. Азот и фосфор — типичные неметаллы. Мышьяк амфотерен, хотя неметаллические, свойства сильнее выражены, чем металлические. Сурьма амфотерна, неметаллические и металлические свойства выражены примерно одинаково. Для висмута характерно преобладание металлических свойств.
 В кислородных соединениях все элементы VА-группы проявляют степени окисления +3 и +5 (для азота характерны кроме того, степени окисления +1, +2, + 4). Оксиды азота N2О3 и фосфора P2О3 являются кислотными и им соответствуют кислоты — азотистая НNО2 и фосфористая Н3РО3. Оксиды мышьяка Аs2О3 и сурьмы Sb2О3 проявляют амфотерные свойства, причем у оксида мышьяка(III) преобладают кислотные свойства. Соответствующие им гидроксиды Аs(ОН)3 и Sb(ОН)3 амфотерны; у первого преобладают кислотные свойства, у второго — основные.
В кислородных соединениях все элементы VА-группы проявляют степени окисления +3 и +5 (для азота характерны кроме того, степени окисления +1, +2, + 4). Оксиды азота N2О3 и фосфора P2О3 являются кислотными и им соответствуют кислоты — азотистая НNО2 и фосфористая Н3РО3. Оксиды мышьяка Аs2О3 и сурьмы Sb2О3 проявляют амфотерные свойства, причем у оксида мышьяка(III) преобладают кислотные свойства. Соответствующие им гидроксиды Аs(ОН)3 и Sb(ОН)3 амфотерны; у первого преобладают кислотные свойства, у второго — основные.
Оксид висмута (III) Вi2О3 и соответствующий ему гидроксид Вi(ОН)3 проявляют основные свойства.
Оксиды типа Э2О3 элементов VА-группы и соответствующие им гидроксиды НЭО3 или Н3ЭО4 проявляют кислотные свойства.
В гидридах типа ЭН3 элементы этой группы проявляют степени окисления —3. Это газообразные водородные соединения. В водных растворах они не отщепляют водород-ионов и поэтому не проявляют кислотных свойств, как, например, гидриды Н2S, НСl VIА- и VIIА-групп. Последнее связано с тем, что вследствие меньшей электроотрицательности по сравнению с р-элементами VIА- и VIIА-групп их связь с водородом менее полярна.
Химические свойства соединений азота. Азот — основной компонент воздуха, где его объемная доля равна 78,2% и массовая доля 76%. Неорганические соединения азота встречаются в природе в незначительных количествах. Массовая доля азота в земной коре (включая гидросферу и атмосферу) составляет 0,04%.
Азот все время извлекается из почвы растениями. В результате этого почва истощается и становится менее плодородной.
В связи с необходимостью вносить в почву азотные удобрения уже в начале XX в. были предприняты усилия по использованию атмосферного азота для получения азотистых соединений, так называемая азотфиксация.
В настоящее время синтез аммиака из водорода и азота — основной способ связывания атмосферного азота. Однако такой способ азотфиксации очень энергоемок и, следовательно, дорог. Поэтому в последнее время многие ученые заняты исследованиями по связыванию атмосферного азота с помощью различных комплексных соединений.
Элементный азот исключительно инертен вследствие большой прочности его двухатомных молекул N2. Энергия диссоциации N2 очень велика. Это обусловлено наличием тройной связи между атомами азота: N≡N. Поэтому при обычной температуре азот реагирует только с литием, при повышенных — с некоторыми металлами: магнием, кальцием, образуя нитриды, при очень высоких непосредственно соединяется с водородом и кислородом.
Из соединений азота, в которых он проявляет степень окисления —3, наибольший интерес для медиков и биологов представляет аммиак и его производные — соли аммония и аминокислоты.
Аммиак. Аммиак NН3 в организме человека является одним из продуктов метаболизма аминокислот и белков, поступивших с пищей или присутствующих в самой клетке в качестве запасных веществ.
 Аммиак — бесцветный газ с резким запахом; очень хорошо растворим в воде: в 1 объеме Н2О при 293 К растворяется около 700 объемов аммиака. В концентрированном водном растворе массовая доля аммиака составляет 25%. В медицинской практике применяют 10%-ный раствор аммиака (нашатырный спирт) для вывода из обморочного состояния. При вдыхании аммиак оказывает возбуждающее влияние на дыхательный центр. При больших дозах наступает удушье.
Аммиак — бесцветный газ с резким запахом; очень хорошо растворим в воде: в 1 объеме Н2О при 293 К растворяется около 700 объемов аммиака. В концентрированном водном растворе массовая доля аммиака составляет 25%. В медицинской практике применяют 10%-ный раствор аммиака (нашатырный спирт) для вывода из обморочного состояния. При вдыхании аммиак оказывает возбуждающее влияние на дыхательный центр. При больших дозах наступает удушье.
В молекуле аммиака атом азота находится в состоянии sр3-гибридизации.
Присутствие на одной из гибридных орбиталей неподеленной пары электронов определяет способность атома азота в аммиаке к образованию связей с другими атомами или ионами по донорно-акцепторному механизму. Этим объясняется характерное свойство аммиака вступать в реакции присоединения с водой, кислотами, катионами металлов.
 Наиболее простой является реакция аммиака с протонами. Аммиак, присоединяя протон, образует ион аммония NН4+.
Наиболее простой является реакция аммиака с протонами. Аммиак, присоединяя протон, образует ион аммония NН4+.
В этой реакции аммиак служит акцептором протонов и с точки зрения протонной теории проявляет свойства основания. В результате связывания протонов понижается их концентрация в растворе, поэтому аммиак, реагируя с кислотами, нейтрализует их. При этом образуются соли аммония, например
NН3 + НNО3 = NН4NО3
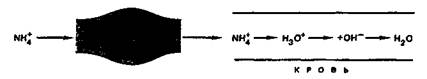
Из солей аммония в медицинской практике в качестве мочегонного средства применяют аммоний хлорид NН4Сl. В крови в результате гидролиза аммония хлорида по катиону повышается кислотность:
NH4+ + 2Н2О ⇄ NН3∙Н2О + Н3О+
Кроме того, протоны образуются в результате превращения аммоний-иона в мочевину:
2NН4+ + СO2 + Н2О = СО(NН2)2 + 2Н3O+
Для нейтрализации избытка ионов Н3О+ почки мобилизуют и выделяют в мочу ионы натрия, с которыми одновременно выделяется соответствующее количество воды.
Вместе с тем аммоний хлорид может быть эффективным средством против защелачивания крови (коррекция алкалоза). Образующиеся при введении NН4+ протоны Н3О+ нейтрализуют ОН--ионы.
 Электронодонорные свойства аммиака и его производных проявляются в их способности образовывать комплексные соединения с ионами металлов. Наиболее прочны комплексы с ионами переходных металлов, предоставляющих, в соответствии с методом валентных связей, свои вакантные d-орбитали для неподеленных пар электронов азота. К числу таких соединений относятся, например, комплексы [Со(NН3)6]3+, [Zn(NН3)4]2+.
Электронодонорные свойства аммиака и его производных проявляются в их способности образовывать комплексные соединения с ионами металлов. Наиболее прочны комплексы с ионами переходных металлов, предоставляющих, в соответствии с методом валентных связей, свои вакантные d-орбитали для неподеленных пар электронов азота. К числу таких соединений относятся, например, комплексы [Со(NН3)6]3+, [Zn(NН3)4]2+.
Вода при взаимодействии с аммиаком передает протон на 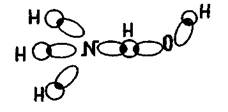 атом азота.
атом азота.
Таким образом, щелочные свойства аммиака являются результатом донорно-акцепторного взаимодействия азота аммиака с протоном воды. Это обратимая реакция. При охлаждении равновесие сдвигается вправо (экзотермический процесс), а при нагревании — влево (выделяется аммиак, на что указывает усиление запаха).
Относительно низкое значение константы основности свидетельствует, что в водных растворах аммиака концентрация гидроксид-ионов незначительна. Аммиак в водном растворе главным образом находится в виде гидрата NН3∙H2О. Экспериментально доказано отсутствие недиссоциированных молекул NH4ОН в растворе. Однако в полном соответствии с протолитической теорией водный раствор аммиака.обладает щелочными свойствами.
Поскольку азот в аммиаке имеет низшую степень окисления —3, в окислительно-восстановительных реакциях NН3 может быть только восстановителем. В кислороде и хлоре аммиак горит:
4NН3 + 3О2 = 2N2 + 6Н2О,
2NН3 + 3Сl2 = N2 + 6НСl.
Известно, что аминокислоты — биоорганические вещества, играющие роль строительных блоков для образования белков — основы жизни. Их можно рассматривать как производные аммиака, в котором один из атомов водорода замещен остатком карбоновой кислоты:
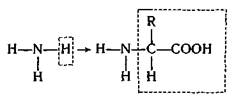
Превращение производных аммиака в организме. Аминогруппа —NH2 входит в состав различных биолигандов, играющих важную роль в процессах жизнедеятельности: аминокислот, нуклеотидов, нуклеиновых кислот и т.д. В процессах распада этих веществ в организме образуется аммиак.
Причина токсического действия аммиака на мозг до конца не выяснена. В крови при рН = 7,4 аммиак почти полностью находится в виде ионов аммония. Из уравнения Гендерсона—Гассельбаха следует,.что доля молекул NН3 при этом значении рН составляет всего около 1% от общего числа молекул аммиака, поступивших в кровь.
Ионы аммония, несмотря на то, что они в крови находятся в большом избытке, не могут проникать через клеточные мембраны, в то время как нейтральные молекулы NH3 легко проходят через эти мембраны и могут воздействовать на мозг.
Кислородные соединения азота. Азот образует с кислородом ряд оксидов. Все они могут быть получены из азотной кислоты и ее солей.
Оксид азота (I) N2O — несолеобразующий. В настоящее время оксид азота(I) в смеси с кислородом используют для наркоза.
При малых концентрациях N2O вызывает чувство опьянения (отсюда название веселящий газ). Вдыхание чистого N2O быстро вызывает наркотическое состояние и удушье. Механизм действия неизвестен.
Оксид азота (II) NO также является несолеобразующим. Для NO характерна окислительно-восстановительная двойственность. Оксид азота (II) легко окисляется кислородом воздуха до оксида азота (IV).
2NО + О2 = 2NО2
Однако он восстанавливается водородом до элементного азота:
2NО + 2Н2 = N2 + 2Н2О.
Оксид азота (IV) NO2 — бурый газ, обладающий характерным запахом, раздражает дыхательные пути. При температурах ниже 25К этот оксид полностью переходит в димер N2O4 — бесцветное кристаллическое вещество. В интервале температур от 25 до 413К имеет место равновесие:
N2O4 ⇄ 2NО2.
Оксид азота (IV) — очень сильный окислитель. Многие вещества горят в нем, отнимая кислород, например:
NO2 + SО2 = SО3 + NO
При растворении в воде NO2 образует азотную и азотистую кислоты:
2NО2 + Н2О = HNО3 + НNО2
Соответственно при взаимодействии с щелочами образуются соли — нитраты и нитриты:
2NО2 + 2КОН = КNО3 + КNО2 + Н2О
Оксиду азоту (III) N2О3 соответствует азотистая кислота НNО2. Это слабая кислота существует только в разбавленных водных растворах. При нагревании или концентрировании раствора азотистая кислота разлагается:
2НNО2 = NO + NО2 + Н2О
Соли азотистой кислоты — нитриты — более устойчивы и при обычных температурах не разлагаются.
Поскольку степень окисления азота в нитритах промежуточная (+3), они могут вести себя и как окислители, и как восстановители:
2NаNO2 + 2КI + 2Н2SО4 = I2 + 2NО + К2SО4 + Na2SO4 + 2Н2О
2КМnО4 + 5NaNО2 + 3Н2SО4 = 2МnSО4 + 5NаNО3 + К2SО4 + 3Н2О
Гидроксидом, соответствующим оксиду азота (V) N2О5, является азотная кислота НNО3 — одно из важнейших неорганических соединений азота. Широко используется в химическом производстве.
НNО3 — сильная кислота, в разбавленных водных растворах полностью диссоциирует на ионы:
НNО3 ⇄ Н+ + NО3-
Азотная кислота, в особенности концентрированная, — очень сильный окислитель. Из металлов с ней не реагируют лишь Аu, Рt, Rh, Ir, Тi, Та. Многие металлы Аl, Fе, Со, Ni и Сr — она пассивирует (очевидно, в результате образования малорастворимой оксидной пленки).
При окислении металлов азотной кислотой обычно получается смесь продуктов ее восстановления, чаще всего преобладают NO и NО2. Состав продуктов зависит от природы металла, температуры и концентрации кислоты. Например, активные металлы (Zn, Са) могут восстанавливать НNО3 до NH4NO3.
Некоторые неметаллы (S, Р, С) также окисляются азотной кислотой, например
S + 6НNО3(конц) = 6NО2 + Н2SО4 + 2Н2О
Соли азотной кислоты — нитраты. Все нитраты хорошо растворимы в воде. Водные растворы нитратов не обладают окислительными свойствами, но их расплавы — сильные окислители.
При производстве азотной кислоты и некоторых других веществ образуются нитрозные газы, представляющие собой смесь оксидов азота: NO, NO2, N2O3, N2О4. При контакте этих газов с влажной поверхностью легких образуются азотистая и азотная кислоты, поражающие легкие, что приводит к отеку и сложным расстройствам. При отравлении нитрозными газами в крови, кроме того, образуются нитраты и нитриты.
Нитриты до последнего времени добавляли в качестве консервантов в колбасу, сосиски и другие мясные продукты. Хотя консерванты добавляют в очень незначительных количествах, существует мнение, что они опасны для человека. Одна из причин ядовитых свойств азотистой кислоты или нитритов в том, что они являются дезаминирующими агентами, способствуют окислению аминогрупп нуклеиновых оснований. Особенно сильное действие оказывает азотистая кислота, образующаяся из органических предшественников, например нитрозаминов, а также из нитросоединений. При этом изменяется структура нуклеиновых оснований ДНК и их способность к образованию водородных связей, т. е. происходят повреждения в ДНК.
Токсическое действие нитритов проявляется и в том, что под их воздействием гемоглобин превращается в метгемоглобин, который не способен связывать и переносить кислород:
НbFе2+ + NО2- ⇄ НbFе3+ + NO
связывает кислород несвязывает кислород
Таким образом, попадая в кровь, нитриты вызывают кислородную недостаточность. Аналогично действуют неорганические нитраты.
Вместе с тем в очень незначительных количествах некоторые неорганические нитриты (соединения типа R—О—N=O) и органические нитраты (R—О—NО2) улучшают коронарное кровообращение и применяются для профилактики при ишемической болезни сердца и снятия приступов стенокардии.
Представителями лекарственных нитритов и нитратов являются натрий нитрит NаNО2 и нитроглицерин (органическое соединение).
Однако в настоящее время NaNO2 почти не используют, так как он может вызвать осложнения из-за метгемоглобиновой гипоксии в организме.
Химические свойства соединений фосфора. В природе фосфор встречается только в формах, содержащих фосфат-анион РО43-. Это обусловлено тем, что для фосфора характерно образование прочных связей с кислородом. Энергии связей Р—Н и Р—С гораздо ниже энергии связи Р—О. Это свойство фосфора отличает его от азота, для которого, наоборот, энергии связей N—Н и N—С значительно выше энергии связи N—О.

|
В природе фосфор встречается в виде минералов — фосфорита Са3(РО4)2 и апатитов с общей формулой 3Са3(РО4)2∙СаХ2, где X = F, Cl, OH. массовая доля фосфора в земной коре составляет 0,04%.
Фосфор существует в виде нескольких аллотропных модификаций. Наиболее изучены белый и красный фосфор.
Белый фосфор очень токсичен. Это обусловлено его хорошей растворимостью в жирах и, следовательно, способностью проникать через мембраны клеток, а также высокой реакционной активностью. Смертельная доза фосфора для взрослого человека составляет приблизительно 0,1г. Остальные аллотропные модификации фосфора вследствие их нерастворимости не токсичны.
Как уже отмечалось, для фосфора наиболее характерно образование связей с кислородом в неорганических и биоорганических соединениях. Поэтому для медиков и биологов наибольший интерес представляют свойства кислородных соединений фосфора.
Оксид фосфора (III) Р2О3 образуется при медленном окислении белого фосфора кислородом:
Р4 + 3О2 = 2Р2О3
Обычная форма Р2Оз имеет кристаллическую решетку, образованную молекулами Р4О6. Кристаллическая структура Р4О6 или (Р2О3)2 определяется тетраэдрическим расположением четырех атомов фосфора в Р4О6 (рис. 8.2).
При действии холодной воды на Р2О3 образуется фосфористая кислота Н3РО3:
Р2О3 + 3Н2О = 2Н3РО3
Молекула Н3РО3 имеет тетраэдрическое строение (sр3-гибридизация атома Р):
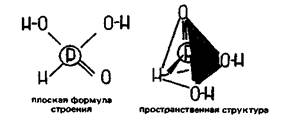
 Только два атома водорода из трех в Н3РО3 связаны с фосфором через кислород и обладают кислотными свойствами. Действительно, Н3РО3 является двухосновной кислотой. Поэтому ее соли — фосфиты — бывают одно- или чаще двузамещенными, например NаН2РО3, Аg2НРО3, К2НРО3.
Только два атома водорода из трех в Н3РО3 связаны с фосфором через кислород и обладают кислотными свойствами. Действительно, Н3РО3 является двухосновной кислотой. Поэтому ее соли — фосфиты — бывают одно- или чаще двузамещенными, например NаН2РО3, Аg2НРО3, К2НРО3.
Большинство солей фосфористой кислоты — фосфитов, кроме фосфитов IА-группы, плохо растворимы в воде..
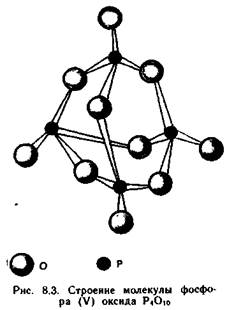
Оксид фосфора (V) Р2О5 — наиболее стабильный оксид фосфора. В газообразном состоянии оксид фосфора (V) имеет состав Р4О10. Молекулы Р4О10 состоят из четырех тетраэдров РО4, каждый из которых связан с тремя соседними через общие атомы кислорода (рис. 8.3). Р2О10 образуется при горении фосфора на воздухе или в кислороде. Этот оксид жадно поглощает воду, поэтому его используют в качестве дегидратирующего средства для осушения газов и органических растворителей:
Р2О5 + хН2О → Р2О5•xН2О
Эти гидраты с разным содержанием воды представляют собой смесь фосфорных кислот. Среди фосфорных кислот, которые содержат фосфор в высшей степени окисления +5, наибольшее значение имеют ортофосфорная кислота Н3РО4 и полифосфорные кислоты. Многообразие полифосфорных кислот вызвано тем, что тетраэдрические структурные единицы РО4 могут различным образом соединяться с соседними единицами РО4.
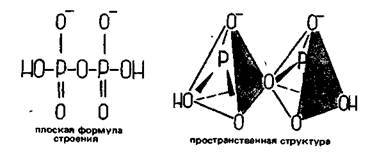 Соединения двух тетраэдров РО43- посредством обобществления одного атома кислорода отвечает образованию дифосфат- (пирофосфат-) иона Р2О74- — аниона дифосфорной (пирофосфорной) кислоты H4Р2О7:
Соединения двух тетраэдров РО43- посредством обобществления одного атома кислорода отвечает образованию дифосфат- (пирофосфат-) иона Р2О74- — аниона дифосфорной (пирофосфорной) кислоты H4Р2О7:
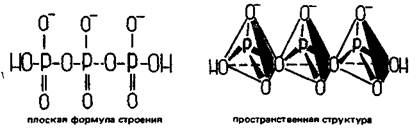 Таким же образом в открытую цепь могут соединяться 3, 4 и большее число тетраэдров. Например, при соединении трех тетраэдров получается трифосфат-анион трифосфорной кислоты:
Таким же образом в открытую цепь могут соединяться 3, 4 и большее число тетраэдров. Например, при соединении трех тетраэдров получается трифосфат-анион трифосфорной кислоты:
Кислоты такого типа с открытой цепью называют полифосфорными.
При взаимодействии Р2О5 с водой на холоду образуется метафосфорная кислота НРО3.
При кипячении разбавленного водного раствора НРО3 образуется ортофосфорная кислота Н3РО4:
НРО3 + Н2О = Н3РО4
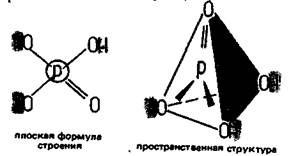 Ортофосфорная кислота в безводном состоянии представляет собой белые кристаллы. В продажу поступает препарат — 90%-ный водный раствор Н3РО4. Эта кислота средней силы. Пространственная структура ортофосфорной кислоты — тетраэдр:
Ортофосфорная кислота в безводном состоянии представляет собой белые кристаллы. В продажу поступает препарат — 90%-ный водный раствор Н3РО4. Эта кислота средней силы. Пространственная структура ортофосфорной кислоты — тетраэдр:
Будучи трехосновной, она образует средние и кислые соли. Средние соли ортофосфорной кислоты называются ортофосфатами или просто фосфатами, например натрий ортофосфат Nа3РО4, кислые с одним атомом водорода — водородфосфатами, например, Nа2НРО4, кислые с двумя атомами водорода — диводородфосфатами, например, NаН2РО4.
Диводородфосфаты растворимы в воде, из водородфосфатов и средних фосфатов хорошо растворимы лишь соли щелочных металлов и аммония.
В водных растворах соли ортофосфорной кислоты гидролизуются. Диводородфосфаты дают при гидролизе кислую среду (рН<7), водородфосфаты — слабощелочную (рН>7), средние фосфаты — щелочную (рН>>7). Так, в 1%-ных водных растворах NаН2РО4 рН=4,6, Nа2НРО4 рН=3,9 и Nа3РО4 рН=12,1. Кислые фосфаты NаН2РО4 и Nа2НРО4 образуют в крови буферную систему, которая вместе с другими буферными системами обеспечивает постоянство рН крови.
Ортофосфорная кислота и труднорастворимые фосфаты алюминия АlРО4 и цинка Zn3(РО4)2 входят в состав фосфат-цементов, применяемых в стоматологии в качестве пломбировочного материала.
Обезвоживание Н3РО4 при 473—523К приводит к получению дифосфорной (пирофосфорной) кислоты Н4Р2О7. Пирофосфорная кислота в свободном состоянии представляет собой твердое вещество. Это более сильная кислота, чем Н3РО4.
 С биологической точки зрения чрезвычайно важными являются бионеорганические производные дифосфорной кислоты Н4Р2О7 и не выделенной в свободном виде трифосфорной кислоты Н5Р3О10. Это аденозиндифосфорная кислота (АДФ) и аденозинтрифосфорная кислота (АТФ). Напомним, что в состав АТФ и АДФ входит азотистое основание (Аd) и пятиуглеродный сахар D-рибоза (R). Строение аниона АТФ4- может быть представлено в виде
С биологической точки зрения чрезвычайно важными являются бионеорганические производные дифосфорной кислоты Н4Р2О7 и не выделенной в свободном виде трифосфорной кислоты Н5Р3О10. Это аденозиндифосфорная кислота (АДФ) и аденозинтрифосфорная кислота (АТФ). Напомним, что в состав АТФ и АДФ входит азотистое основание (Аd) и пятиуглеродный сахар D-рибоза (R). Строение аниона АТФ4- может быть представлено в виде
Являясь бионеорганическими производными дифосфорной и трифосфорной кислот, АДФ и АТФ во многом ведут себя при ионизации аналогично этим кислотам. Так, для дифосфорной кислоты значение рКа третьей ступени составляет 6,7 а для АТФ рКа второй ступени равно 7,2.
При физиологическом рН=7,4 АТФ и АДФ практически полностью существуют в виде анионов АТФ4- и АДФ3-, т.е. их фосфатные группы почти полностью ионизированы.
Подобно анионам полифосфорных кислот анионы АТФ4- и АДФ3- подвергаются гидролизу.
В результате присоединения одной молекулы воды АТФ4- гидролизуется до аниона аденозиндифосфата АДФ3- и водородфосфат-иона НРО42-:
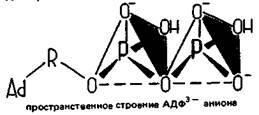
Как и полифосфорные кислоты, АДФ и АТФ образуют с катионами металлов комплексные соли. Так, во внутриклеточной жидкости АТФ и АДФ присутствуют главным образом в виде комплексов с магнием: МgАТФ2- и МgАДФ-.
В очень многих ферментативных реакциях, в которых АТФ участвует в качестве донора фосфатной группы, активной формой АТФ является комплекс МgАТФ2-. Главным образом по этой причине магний — жизненно необходимый элемент для организма.
Среди соединений фосфора со степенью окисления —3 следует отметить очень токсичный гидрид фосфора РН3 Это аналог аммиака, называемый фосфином РН3 является сильным восстановителем и способен осаждать тяжелые металлы из растворов солей. Электронодонорные свойства фосфина слабее, чем у аммиака. Только при действии на него сильных доноров протонов — НСlО4, НI — образуются малоустойчивые кристаллические вещества — соли фосфония:
РН3 + НI = РН4I
Химические свойства важнейших соединений мышьяка, сурьмы, висмута. Массовая доля этих элементов в земной коре составляет: Аs — 1,7∙10-4%, Sb — 5∙10-5%, Вi — 2∙10-5%. Для мышьяка одинаково характерны степени окисления +3 и +5, сурьма чаще проявляет в соединениях степень окисления +3, хотя имеются соединения, в которых Sb проявляет степень окисления +5 (SbСl5 и др.). Для висмута известно много соединений Вi3+, в то время как вещества, содержащие Вi5+, немногочисленны и являются сильными окислителями.
Соединения мышьяка, сурьмы и висмута очень ядовиты, в особенности катионные соли Аs3+ и арсин АsН3.
При переходе от фосфора к мышьяку, сурьме и висмуту усиливается тенденция к образованию соединений с серой и серосодержащими лигандами. В отличие от азота (в биомолекулах наиболее характерны связи с водородом и углеродом) и фосфора (характерны связи с кислородом) более тяжелые элементы VА-группы Аs, Sb, Вi склонны образовывать связи с кислородом и с серой. В частности, в природе Аs, Sb и Вi, как правило, встречаются в виде сульфидов Аs2S3, Sb2S3, Bi2S3.
Среди соединений мышьяка, сурьмы и висмута со степенью окисления —3 интерес представляют газообразные водородные соединения: арсин АsН3, стибин SbН3 и висмутин ВiНз. Все они очень токсичны.
Степень окисления +3 мышьяк и его аналоги проявляют в галогенидах ЭГ3, оксидах Э2О3 и сульфидах Э2S3.
Оксид мышьяка (III) Аs2О3 — амфотерный оксид с преобладанием кислотных свойств. Аs2О3 растворяется в воде с образованием гидроксида:
Аs2О3 (т) + 3Н2О (ж) = 2Н3АsО3 (р) или Аs(ОН)3
Гидроксид мышьяка (III) — амфотерен, но так же, как у Аs2О3, у него преобладают кислотные свойства. В свободном состоянии Аs(ОН)3 не выделен, в водном растворе ведет себя как слабая кислота Н3АsО3, называемая ортомышьяковистой (мышьяковистой). В водных растворах она находится в равновесии с метамышьяковистой кислотой НАsO2:
Н3АsО3 ⇄ НАsО2 + Н2О
Соли этих кислот соответственно называются ортоарсенитами и метаарсенитами. Из водных растворов обычно кристаллизуются метаарсениты состава МЭО2.
Соединения мышьяка (V) и в особенности мышьяка (III) очень токсичны. Механизм токсического действия объясняют способностью мышьяка блокировать сульфгидрильные группы —SН ферментов и других биологически активных соединений. Например, в организме человека мышьяк взаимодействует с глутатионом — веществом, представляющим собой соединение трех аминокислот — глутаминовой кислоты, цистеина и глицина. При этом блокируется сульфгидрильная группа и глутатион теряет одну из важных своих биологических функций — восстановление токсичных пероксидов. Упрощенно этот процесс можно представить следующим образом:
 , где R — радикал глутамата-иона.
, где R — радикал глутамата-иона.
Кроме того, мышьяк может замещать иод, селен и фосфор. Нарушая биохимические процессы метаболизма в организме, Аs является антиметаболитом этих элементов.
Смертельная доза для человека составляет приблизительно 0,1—0,3г мышьяка.
Однако соединения мышьяка не только убивают, но и помогают в борьбе за жизнь. Так, при остром отравлении оксидом мышьяка (III) смерть наступает примерно через 70ч. В то же время это вещество применяют наружно (препарат белый мышьяк) при кожных заболеваниях. В стоматологической практике Аs2О3 используют для омертвления (некротизации) мягких тканей зуба. Кроме того, этот препарат назначают в микродозах (0,001г на прием) при малокровии, истощении, нервозности.
Интересно, что организм может привыкнуть к Аs2О3, если его вводить постепенно, увеличивая дозу.
В медицинской практике используют и раствор калия арсенита К3АsО3 (Фаулеров раствор мышьяка). Препарат применяют при тех же заболеваниях, что и Аs2О3. Это нетрудно объяснить тем, что в обоих случаях в кислой среде желудка образуется мышьяковистая кислота:
Аs2О3 + 3Н2О = 2Н3АsО3
АsО33- + 3Н+ = Н3АsО3
Механизм действия этих препаратов, очевидно, связан с блокированием сульфгидрильных групп.

|
Оксид сурьмы (III) Sb2О3 и оксид висмута (III) Вi2О3 в воде нерастворимы. Оксид сурьмы — амфотерен, а оксид висмута имеет основной характер. Вi2О3 (50 —55%) входит в состав препарата ксероформ. Применяют наружно как вяжущее средство, подсушивающее и антисептическое средство.
При гидролизе солей Sb3+ и Вi3+ образуются оксосоли:
SbСl3 + Н2О ⇄ SbОСl + 2НСl
Вi(NО3)3 + Н2О ⇄ ВiONО3 + 2НNО3
Оксосоли Sb3+ и Bi3+ можно рассматривать как соединения радикалов антимонила (стибила) SbО+ и висмутила ВiO+. Отсюда их названия: антимонил хлорид, висмутил нитрат. Препарат висмута нитрат основной состоит из смеси продуктов гидролиза Вi(NО3)3: Вi(ОН)2NО3, ВiONО3 и дегидратированного висмута гидроксида ВiOОН. Препарат применяют в качестве вяжущего и отчасти антисептического средства при желудочно-кишечных заболеваниях. На рис. 8.4 показаны превращения Вi(NO3)3 при поступлении в организм.
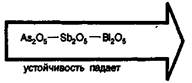 Важнейшие соединения Аs (V), Sb (V), Вi (V). Оксиды высшей степени окисления тяжелых элементов VА-группы Э2О5 при обычных условиях — твердые вещества. Устойчивость этих оксидов уменьшается при переходе от мышьяка к висмуту:
Важнейшие соединения Аs (V), Sb (V), Вi (V). Оксиды высшей степени окисления тяжелых элементов VА-группы Э2О5 при обычных условиях — твердые вещества. Устойчивость этих оксидов уменьшается при переходе от мышьяка к висмуту:
При растворении в воде Аs2О5 образуется мышьяковая кислота Н3АsО4:
Аs2О5 + 3Н2О = 2Н3АsО4
Это кислота средней силы — аналог ортофосфорной кислоты Н3РО4.
Оксид Sb2О5 плохо растворим в воде. При попытке получения сурьмяных кислот образуется осадок Sb2О5∙ x Н2О. В свободном состоянии не выделены и кислородные кислоты Вi (V).
Соли Н3АsО4 — арсенаты вследствие сходства строения электронных оболочек атомов Р и Аs похожи на ортофосфаты. Существует три ряда солей: арсенаты, например Nа3АsО4, Са3(АsО4)2, гидроарсенаты, например Nа2НАsО4, и дигидроарсенаты, например NаН2АsО4, Са(Н2АsО4)2.
В отличие от фосфора, у которого токсичны только соединения фосфора(III), мышьяк токсичен и в степени окисления +5. Последнее обусловлено тем, что в организме человека мышьяк (V) легко восстанавливается до соединений мышьяка (III).
В медицинской практике используют NаH2АsО4∙7Н2О в виде 1%-ного раствора при нервных расстройствах, легких формах малокровия. Механизм действия препарата также, очевидно, связан с блокированием сульфгидрильных групп белков, ферментов.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2092; Нарушение авторских прав?; Мы поможем в написании вашей работы!