
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амінокислоти
|
|
|
|
Хімічний склад білків
Елементний склад. Дослідження елементного складу білків розпочалось ще на початку XIX ст. Перші дані про елементарний склад білків з’явились у 1809 р. на основі досліджень Ф. Грена. У результаті хімічного аналізу білків було визначено їх важливі складові елементи та кількісне співвідношення. Так, було встановлено, що до складу білків входять, %: вуглець – 50 – 55, водень – 6,5 – 7,3, азот – 15 – 17, кисень – 21 – 23, сірка – 0,3 – 2,5. У складі білків було виявлено також фосфор, йод, залізо та інші елементи.
Амінокислотний склад. Разом з визначенням елементного складу білків було розпочато вивчення і їх будови. Спочатку вважали, що основними структурними компонентами молекул білка є пептони, які було виділено при гідролізі різних білків. Пізніше (серед продуктів розщеплення білків) дослідники звернули увагу на речовини, які довгий час розглядалися ними не як складові частини молекул білка, а як продукти дії на білкові речовини сильних хімічних реагентів.
У 1820 р. А. Браконно вперше при кислотному гідролізі білка (желатини) виділив амінокислоту – гліцин. Оскільки амінокислота була солодка на смак, то її назвали глікоколом. Дещо пізніше (у 1871 р. російським хіміком М.М. Любавіним) було доведено, що і при ферментативному гідролізі білки розкладаються на амінокислоти.
Отже, в другій половині XIX ст. було встановлено, що основними структурними компонентами білка є амінокислоти.
У живих клітинах синтезується багато макромолекул (білків, нуклеїнових кислот, полісахаридів), які відіграють роль структурних компонентів, біокаталізаторів, гормонів, рецепторів або в них зосереджена генетична інформація. Ці макромолекули представляють собою біополімери, які побудовані з мономерних одиниць, або структурних блоків. В нуклеїнових кислотах мономерними одиницями є нуклеотиди, в складних полісахаридах – цукри і їх похідні, а в білках – L-a-амінокислоти.
Білки, крім того можуть містити й інші компоненти, однак трьохвимірна структура, а відповідно, й їх біологічне значення визначається в основному амінокислотним складом, порядком чергування амінокислот в поліпептидному ланцюзі і як наслідок їх взаємним просторовим розміщенням.
Амінокислоти в клітинах виконують багато важливих функцій; деякі з біологічно важливих сполук, які утворюються із амінокислот наведені в таблиці 3.
Біологічне значення. Амінокислоти являючись будівельними блоками пептидів і білків, виконують і ряд інших важливих функцій. Деякі з них, мабуть приймають участь у передачі нервових імпульсів; прикладами служать гліцин і глютамінова кислота. В їжі повинні міститися незамінні амінокислоти, оскільки організм людини не здатен синтезувати їх в кількостях, достатніх для росту. В результаті метаболізму амінокислот утворюється багато сполук, які мають важливе біологічне значення. Наприклад, при декарбоксилуванні деяких амінокислот утворюються відповідні аміни, і деякі з них (гістамін, g-аміномасляна кислота (ГАМК)) виконують важливі біологічні функції. Ряд аномальних процесів, які виникають в організмах, пов’язані з порушенням транспорту амінокислот до клітин.
Амінокислоти містять в якості функціональних груп аміногрупу і карбоксильну групу. В a-амінокислотах обидві вони зв’язані з одним і тим же (a) вуглецевим атомом:

У природі існує близько 300 амінокислот, однак в білках виявлено тільки 20 з них. У результаті повного гідролізу білків вивільняється 20 L-a-амінокислот (табл. 1). Одні і ті ж 20 амінокислот присутні в білкових молекулах всіх форм життя – рослин, тварин і мікроорганізмів. Чому це так – ми зрозуміємо пізніше, коли будемо обговорювати універсальну природу генетичного коду. Однак, у ряді білків зустрічаються похідні деяких амінокислот, які утворюються вже після включення звичайних амінокислот в молекулу білка (табл. 3).
За виключенням гліцину, у якого R – це атом гідрогену, у всіх амінокислот чотири групи, зв’язані з a-вуглецевим атомом, різні. Дякуючи тетраедричному розміщенню чотирьох різних груп відносно a-вуглецевого атома амінокислота володіє оптичною активністю (здатністю обертати площину поляризації плоскополяризованого світла). Одні амінокислоти, що входять до складу білків, є (при рН=7,0) правообертаючими, а інші – лівообертаючими, однак всі вони мають абсолютну конфігурацію L-гліцеральдегіду і тому є L-a-амінокислотами.
Іонні форми амінокислот. Амінокислоти несуть по крайній мірі дві слабоіонізуючі кислі групи, –СООН і –NH3+. У розчині ці групи знаходяться у двох формах, зарядженій і незарядженій, між якими підтримується протонна рівновага:
R–СООН Û R–СОО- + Н+ і R–NН3+ Û R–NН2 + Н+.
Групи R–СООН і R–NН3+ є протонованими партнерами, тобто кислотами, а R–СОО- і R–NН2 – спряженими основами, тобто акцепторами протонів відповідних кислот. При значеннях рН, характерних для плазми крові і міжклітинної рідини (7,4 і 7,1 відповідно), карбоксильні групи знаходяться виключно у формі карбонілатних іонів, R–СОО-. При цих же значеннях рН більша частина аміногруп знаходиться переважно у асоційованій формі, R–NН3+. Однак в багатьох рівняннях краще використовувати не дисоційовані форми молекул амінокислот, наприклад при обговоренні питання про хімізм реакцій.
Повний сумарний заряд (алгебраїчна сума всіх позитивних і негативних зарядів) амінокислоти залежить від рН середовища, тобто від концентрації протонів гідрогену в розчині. Заряд амінокислоти або її похідного можна змінити, варіюючи значенням рН середовища; це полегшує фізичне розділення амінокислот, пептидів, білків.
Значення рН, при якому сумарний заряд молекули амінокислоти дорівнює нулю, називається ізоелектричною точкою (рІ), саме тому вона не переміщується в постійному електричному полі. Значення ізоелектричної точки знаходиться між найближчими значеннями рК дисоціюючих груп по різні сторони від рІ.
Структура амінокислот. Амінокислоти, які входять до складу білків, є можливість розбити на дві великі групи на основі того, якими є R–групи, зв’язані з атомом a-вуглецю, – полярними і неполярними (табл. 2).
Усі амінокислоти, які виявлено в складі білків, синтезуються в рослинних організмах. В організмі людини і тварин синтезується лише частина протеїногенних амінокислот, а деякі з них утворюються в недостатній кількості для нормального синтезу. В зв’язку з цим усі їх поділяють на три групи: замінні, напівзамінні і незамінні (табл. 2). Останні дві групи в організмі синтезуються в недостатній кількості або не синтезуються взагалі, і тому вони повинні надходити до організму ззовні, в основному з їжею.
Таблиця 1
L-a-амінокислоти, які входять до складу білків1 )
| № | Назва | Скорочене позначення | Структурна формула | |
| З аліфатичними боковими ланцюгами | ||||
| Гліцин | Глі Gly G | 
| ||
| Аланін | Ала Ala A | 
| ||
| Валін | Вал Val V | 
| ||
| Лейцин | Лей Leu L | 
| ||
| Ізолейцин | Іле Ile I | 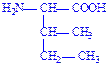
| ||
| З боковими ланцюгами, які містять гідроксильні (ОН) групи | ||||
| Серин | Сер Ser S | 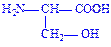
| ||
| Треонін | Тре Thr T | 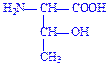
| ||
| Тирозин | Тир Tyr Y | див. нижче | ||
| З боковими ланцюгами, які містять атоми сірки | ||||
| Метіонін | Мет Met M | 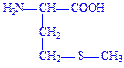
| ||
| Цистеїн2) | Цис Cys C | 
| ||
| Імінокислоти | ||||
| Пролін | Про Pro P | 
| ||
| З боковими ланцюгами, які містять кислі групи і їх аміди | ||||
| Аспарагінова кислота | Асп Asp D | 
| ||
| Аспарагін | Асн Asn N | 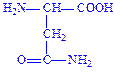
| ||
| Глютамінова кислота | Глу Glu E | 
| ||
| Глютамін | Глн Gln Q | 
| ||
| З боковими ланцюгами, які містять основні групи | ||||
| Аргінін | Арг Arg R | 
| ||
| Лізин | Ліз Lys K | 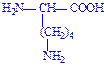
| ||
| Гістидин | Гіс His H | 
| ||
| Амінокислоти, які містять ароматичні кільця | ||||
| Гістидин | Гіс His H | див. вище | ||
| Фенілаланін | Фен Phe F | 
| ||
| Тирозин | Тир Tyr Y | 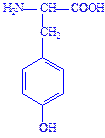
| ||
| Триптофан | Три Trp W | 
|
1) За виключенням гідроксилізину і гідроксипроліну, які включаються до молекул білків у вигляді лізину та проліну, а потім гідроксилюються, для всіх перерахованих в таблиці амінокислот є специфічні тРНК, тому їх включення в білок здійснюється під прямим генетичним контролем.
2) Цистин складається із двох молекул цистеїну, з’єднаних дисульфід ним зв’язком:
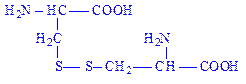
У таблиці 1 наведені трьохбуквенні і однобуквені позначення амінокислот, які широко використовуються в біохімії. Однобуквені позначення застосовуються для запису досить довгих амінокислотних послідовностей (наприклад, повних амінокислотних послідовностей білків).
Таблиця 2
Класифікація L-a-амінокислот, які входять до складу білків,
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1520; Нарушение авторских прав?; Мы поможем в написании вашей работы!