
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмотические свойства дисперсных систем
|
|
|
|
Осмос – это самопроизвольное проникновение растворителя в раствор через полунепроницаемую перегородку, через которую может проникать только растворитель. Явление осмоса характерно и для коллоидных систем.
П – количественно равно избыточному давлению, которое нужно приложить к раствору, чтобы прекратился осмос и установилось равновесие.

Лиозоли (истинно-коллоидные системы с жидкой дисперсной средой) подчиняются тем же уравнениям для осмотического давления, каким следуют истинные растворы. Осмотические свойства заметно проявляются у лиофилизированных золей, в которых наблюдается сольватация частиц.
Осмотическое давление в растворе описывается следующим термодинамическим соотношением:
 (6.16)
(6.16)
где  - разность
- разность 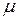 - потенциалов растворителя после установления равновесия относительно полупроницаемой мембраны (только для растворителя) между раствором и чистым растворителем.
- потенциалов растворителя после установления равновесия относительно полупроницаемой мембраны (только для растворителя) между раствором и чистым растворителем.
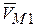 - средний парциальный мольный объем растворителя, находящегося под давлением Р и Р+П.
- средний парциальный мольный объем растворителя, находящегося под давлением Р и Р+П.
а1 – активность растворителя в растворе.
а чистого растворителя принята за 1.
Соотношение (6.16) справедливо и для лиозолей. Чтобы перейти от а к С будем считать раствор разбавленным, тогда по закону Вант-Гоффа:
П = С R T (6.17)
где С – концентрация растворенного вещества, моль/л.
Для лиозолей частичная концентрация 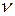 (число частиц в 1 объема) равна
(число частиц в 1 объема) равна 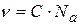 , тогда осмотическое давление для лиозолей:
, тогда осмотическое давление для лиозолей:
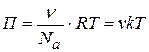 (6.18)
(6.18)
Из уравнения (6.18) видно, что П увеличивается с ростом числа частиц в единице объема даже при постоянной массе дисперсной фазы, т.е. П увеличивается с ростом дисперсности.
Рассмотрим 2 случая:
1). Если взять 2 лиозоли с равными по размеру частицами (m 1 = m 2, r 1 = r 2), но с разными частичными концентрациями v1 и v2, то их массовые (объемные) концентрации тоже будут отличаться:  ;
; 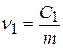 , m – масса частицы
, m – масса частицы

Осмотическое давление этих лиозолей соответственно будут равны:
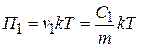 ;
; 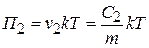
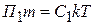 ;
; 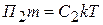 , отсюда
, отсюда
 или
или 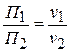 (6.19)
(6.19)
т.е. П пропорционально частичной концентрации, массовой или объемной.
2). Если массовые концентрации одинаковы С1 = С2 = С в золях с разным размером и массой частиц (m 1 m 2, r 1
m 2, r 1 r 2), тогда
r 2), тогда
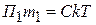
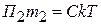 тогда
тогда 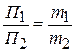 (6.20)
(6.20)
Для сферической частицы  , тогда
, тогда
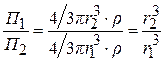 (6.21)
(6.21)
Из соотношения (6.20) видно, что П очень сильно зависит от размера частиц, это свойство используется для определения размера частиц и определения их агрегации.
Осмотическое давление в коллоидных растворах мало по сравнению с П в истинных растворах, т.к. при одной и той же массовой концентрации, численная концентрация в коллоидных системах меньше.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2137; Нарушение авторских прав?; Мы поможем в написании вашей работы!