
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитами
|
|
|
|
Закономерности коагуляции гидрофобных дисперсных систем
Лиофобные системы агрегативно устойчивы благодаря проявлению электростатического фактора и коагулируют при введении в систему небольших количеств электролитов.
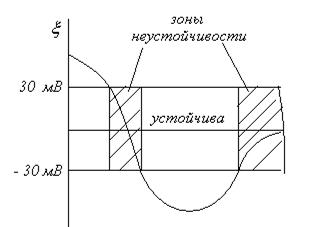
Наименьшая концентрация электролита См, при которой начинается коагуляция (медленная), называется порогом коагуляции. Быстрая коагуляция требует такой концентрации электролита Сб, после увеличения которой скорость коагуляции остается постоянной (фактор устойчивости W =1, потенциальный барьер 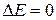 ).
).
На рисунке показано изменение скорости коагуляции от концентрации электролита.
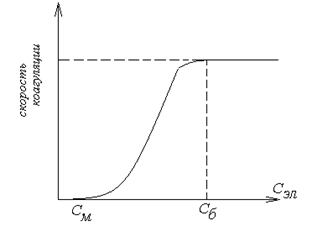
При введении электролита в систему снижается потенциальный барьер. Порог коагуляции зависит от времени фиксирования его, метода наблюдения за коагуляцией (рассеяние света, реологические свойства) и концентрации золя.
В соответствии с теорией ДЛФО добавление электролита в дисперсную систему приводит к сжатию ДЭС у частиц, вследствие чего частицы могут подойти друг к другу на такое расстояние, где преобладают силы притяжения. Сжатие ДЭС происходит за счёт уменьшения потенциала в результате адсорбции ионов электролита – нейтрализационная коагуляция и за счет ограничения диффузии противоионов в раствор в связи с увеличением ионной силы раствора – концентрационная коагуляция.
По теории ДЛФО при концентрации электролита, равной порогу коагуляции, потенциальная кривая ДС находится в области отрицательных значений. Только max, отвечающий 0- му потенциальному барьеру, лежит на оси абсцисс. Точке касания соответствуют два условия: 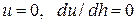 .
.
Эти условия отвечают некоторому критическому потенциалу (~ 25-40 мВ). Для малых потенциалов справедливо соотношение:
 (9.41)
(9.41)
где hкр и æ кр – критические значения расстояния между частицами и 
 - критическая толщина диффузного слоя
- критическая толщина диффузного слоя
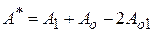 (9.42)
(9.42)
где 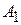 и
и 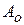 - const Гамалера для дисперсной фазы и дисперсной среды
- const Гамалера для дисперсной фазы и дисперсной среды
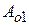 - const взаимодействия фазы и среды
- const взаимодействия фазы и среды
Если поделить уравнение (9.41) на уравнение (9.42), получим
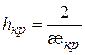 (9.43)
(9.43)
При введении электролита меняется 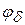 и æ кр (потенциал диффузной части Д и
и æ кр (потенциал диффузной части Д и  ).
).
Подставим уравнение (9.43) в уравнение (9.41), найдём отношение
 или в общем виде
или в общем виде 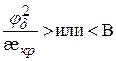 (9.44)
(9.44)
Const В служит мерой устойчивости системы и коагуляции. Условие (9.44) установлено Эйлером и Корфом (1905) и теоретически обосновано Дерягиным.
Если  > В, система агрегативно устойчива.
> В, система агрегативно устойчива.
Если  < В, система неустойчива, происходит коагуляция.
< В, система неустойчива, происходит коагуляция.
Найдём зависимости Сб от Z – заряда противоионов. Для этого подставим значение æкр (æ2 = 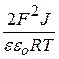 ) в уравнение (9.44)
) в уравнение (9.44)
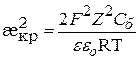 ,
, 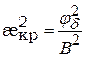
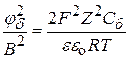
 в области малых потенциалов (9.45)
в области малых потенциалов (9.45)
В области больших потенциалов энергия взаимодействия между частицами практически не зависит от 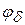 , условие устойчивости ДЭС и коагуляции определяется толщиной диффузного слоя и критической концентрацией электролита (Сб):
, условие устойчивости ДЭС и коагуляции определяется толщиной диффузного слоя и критической концентрацией электролита (Сб):
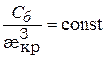 (9.46)
(9.46)
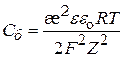 (9.47)
(9.47)
Хорошо согласуется с правилом Шульца – Гарди правило Дерягина – Ландау:
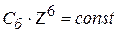 или
или 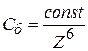 (9.48)
(9.48)
Нейтрализационная коагуляция характерна для ДС, в которых частицы обладают малым электрическим потенциалом. За счёт адсорбции ионов, имеющих заряд, одноименный с зарядом противоионов, нейтрализация 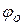 -потенциала происходит в адсорбционном слое.
-потенциала происходит в адсорбционном слое.
При введении электролита в количестве выше max значение ДС может перейти во вторую область устойчивости, где частицы будут иметь противоположный заряд по сравнению с начальным зарядом частиц.
Концентрационная коагуляция, обусловленная сжатием ДЭС за счёт увеличения J раствора, наблюдается при добавлении в ДС индефферентных электролитов, не способных к специфике адсорбции.
Коагуляционное действие электролитов сильно зависит от заряда противоионов. При малых потенциалах на поверхности частиц порог коагуляции зависит от потенциала и ~ 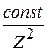 , а при больших потенциалах
, а при больших потенциалах 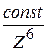 .
.
Правило Шульца – Гарди:
Z1 = 1; Z2 = 2; Z3 = 3
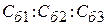 = 1: 1/20: 1/300 (9.49)
= 1: 1/20: 1/300 (9.49)
По правилу Дерягина – Ландау:
Сб ~ 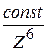
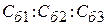 =
= 
На величину порога коагуляции влияет и природа иона. Например, пороги коагуляции уменьшаются в ряду противоионов
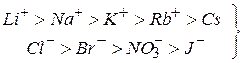 лиотропные ряды
лиотропные ряды
С увеличением R увеличивается сорбируемость, уменьшается Сб.
Это объясняется сродством ионов к растворителю. Чем ионы более лиофобны, тем большим коагуляционным действием они обладают, это объясняется специфической адсорбцией этих рядов.
Если взять смесь электролитов, то иногда наблюдается неаддитивное коагулирующее действие.
Иногда для начала коагуляции требуется большее количество смеси электролитов, чем одного из них. Такое явление называют антагонизмом электролитов. Фрейндлих считал, что это связано со способностью одного иона понижать адсорбцию, а следовательно, коагулирующую силу другого иона.
Кроме того, на коагулирующее действие может влиять химическое взаимодействие между ионами, в результате чего образуются комплексы или нерастворимые соединения, не обладающие коагулирующим действием.
1) Аддитивное действие электролитов.
2) Синергизм электролитов – смесь электролитов действует эффективнее одного электролита, для коагуляции золя их требуется меньше, чем это нужно по правилу аддитивности.
На рисунке приведена зависимость 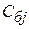 от
от 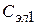
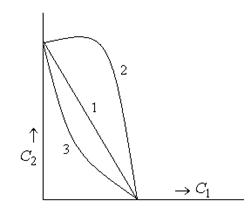
Антагонизм и синергизм при коагулирующем действии электролитов
1 – аддитивное действие электролитов
2 – антагонизм действия электролитов
3 – синергизм действия электролитов
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 423; Нарушение авторских прав?; Мы поможем в написании вашей работы!