
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Показники якості води
|
|
|
|
Основними показниками, які характеризують якість сирої, живильної і котлової води є:
а) Сухий залишок, характеризує вміст розчинених і колоїдних неорганічних і частково органічних твердих домішок в мг/кг чи мкг/кг. Це залишок, висушений при 1100С до постійної ваги після випаровування води, профільтрованої через щільний паперовий фільтр.
б) Загальний солевміст – загальна кількість мінеральних речовин, розчинених в даній воді, мг/кг чи мкг/кг.
в) Жорсткість води – характеризує вміст в ній кальційових і магнійових солей, які обумовлюють здатність води до накипоутворювання.
Розрізняють тимчасову, постійну і загальну жорсткість води.
Тимчасова (карбонатна) жорсткість характеризується вмістом у воді бікарбонатів Са і Мg – Ca(HCO3)2 і Мg(HCO3)2.
Постійна жорсткість характеризує вміст у воді кальційових і магнійових солей неорганічних кислот, а саме:
CaSO4, MgSO4, CaCl2, MgCl2,Ca(NO3)2, Mg(NO3)2, CaSiO3, MgSiO3, Ca(PO4)2, Mg(PO4)2.
За одиницю жорсткості води приймають 1 міліграм (або мікрограм) – еквівалент СаО чи MgO або іонів Са2+ і Mg2+ на 1 кг води.
Для Са2+ 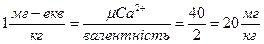 ;
;
Для Mg2+ 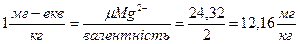 ; (2-47)
; (2-47)
Для 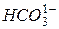
 ;
;
де:  ,
,  ,
, 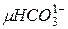 - молекулярна маса кальцію, магнію, і аніону
- молекулярна маса кальцію, магнію, і аніону 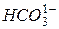 .
.
Величина загальної жорсткості води дорівнює сумарній концентрації катіонів Са і Mg вираженій в 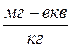
Ж =
=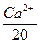 +
+ 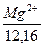
 , (2-48)
, (2-48)
,
де:  і
і  - концентрація в воді катіонів Са і Mg,
- концентрація в воді катіонів Са і Mg, 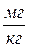 ,
,
а 20 і 12,16 – визначена вище еквівалентна маса катіонів Са і Mg, 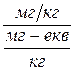 .
.
Величина карбонатної жорсткості визначається
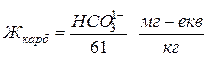 , (2-49)
, (2-49)
де: 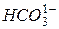 - концентрація у воді аніонів бікарбонатів кальцію і магнію,
- концентрація у воді аніонів бікарбонатів кальцію і магнію,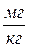 , а 61 – еквівалентна маса аніону бікарбонатів.
, а 61 – еквівалентна маса аніону бікарбонатів.
Тоді величина постійної жорсткості визначається як:
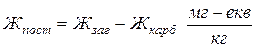 . (2-50)
. (2-50)
За величиною загальної жорсткості природних вод встановлена така класифікація:
 – мала жорсткість води;
– мала жорсткість води;
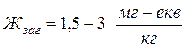 – середня жорсткість води;
– середня жорсткість води;
 – підвищена жорсткість води;
– підвищена жорсткість води;
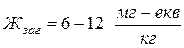 – висока жорсткість води;
– висока жорсткість води;
 – дуже висока жорсткість води.
– дуже висока жорсткість води.
Води рік містять не > 500-600 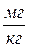 розчинних солей, їх основні компоненти
розчинних солей, їх основні компоненти  ,
,  ,
,  і аніони
і аніони 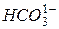 ,
, ,
,  .
.
Маломінералізовані води рік мають в основному  і
і 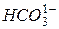 .
.
Підземні води мають велике розмаїття хімічного складу, їх мінералізація складає від 100 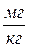 до декількох грам на кг.
до декількох грам на кг.
Г) Лужність води характеризує вміст в ній лужних сполук, таких як: гідратів (NaOH та інші), карбонатів (Na2CO3 та інші), бікарбонатів (NaHCО3 та інші), фосфатів (Na3PO4 та інші) – натрію, кальцію і магнію.
Величина лужності води дорівнює сумарній концентрації в ній гідроксильних (ОН), карбонатних (СО3), бікарбонат них (НСО3), фосфатних (PO4) аніонів слабких кислот, виражений в 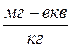 або
або 
Розрізняють лужність:
- гідратну (обумовлена наявністю у воді гідроксильних аніонів 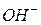 );
);
- карбонатну (обумовлена наявністю у воді карбонатних аніонів  );
);
- бікарбонатну (обумовлену наявністю у воді бікарбонатних аніонів 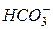 ).
).
Д) Концентрація іонів водню
У воді проходить постійно зворотний процес дисоціації молекул води на іони  і гідроксильні іони
і гідроксильні іони 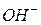
 ↔
↔  +
+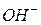
Кількість молекул, які дисоціюють одночасно, дуже незначне приблизнодорівнює одній десятимільйонній частині (10¯⁷) всіх молекул. В результаті цієї дисоціації у воді міститься деяка рівноважна кількість іонів водню і гідроксильних іонів. В хімічно чистій воді концентрація іонів  і
і 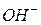 однакова.
однакова.
Поява у воді дисоційованих кислот чи лугів приводить до зростання концентрації, відповідно, іонів  чи
чи 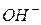 .
.
Відповідно до закону діючих мас
 , (2-51)
, (2-51)
де: 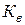 –іонний добуток води. При температурі 22 оС
–іонний добуток води. При температурі 22 оС 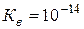 .
.
Оскільки для хімічно чистої води 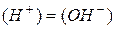 , то концентрація водневих і гідроксильних іонів в ній при 22 оС дорівнює
, то концентрація водневих і гідроксильних іонів в ній при 22 оС дорівнює
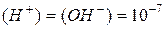 . (2-52)
. (2-52)
На практиці концентрацією 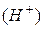 виражають не безпосередньо, а через їївід’ємний логарифм і позначають рН:
виражають не безпосередньо, а через їївід’ємний логарифм і позначають рН:
 .
.
Для води, що містить розчинені кислоти, рН <7, а розчинені луги – рН >7.
Є) Вміст корозійно-активних газів у воді – характеризується вмістом в ній кисню і вуглекислого газу 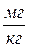 або
або 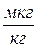
2.9.2. Технологічний процес підготовки живильної води
Висхідну сиру воду з рік чи водойм очищають від:
- грубодисперсних і колоїдних домішок;
- від солей, які можуть спричинити відкладання накипу на поверхні нагріву котлів;
- та звільняють від розчинного у воді повітря.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!