
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольні питання до теми 3.9С
|
|
|
|
Полярографічна комірка, типи електродів. Класична полярографія. Теоретичні основи методу. Якісний та кількісний аналізи. Інверсійний електрохімічний аналіз. Умови інверсійного аналізу. Амперметричне титрування.
С Вольтамперометрія.
Контрольні питання до теми 3.8С
1.На якому принципі засновано нефелометричний аналіз?
2.На якому принципі засновано турбідіметричний аналіз?
3.Як пов’язані між собою кількість розсіяного суспензією речовини світлового потоку з довжиною хвилі?
4.Які прибори використовуються для нефелометричного аналізу?
5.Які прибори використовуються для турбідіметричного аналізу?
Вольтамперометрія – це загальна назва методів аналізу, які засновані на аналізі поляризаційних кривих залежності струму від потенціалу(полярограм), які отримані у електролітичній комірці з індикаторним електродом, що поляризується, і електродом порівняння, який не поляризується. В цих методах використовується явище концентраційної поляризації електроду і утворення дифузійного току. Він розроблений чеським вченим Я.Гейровським(за розвиток теорії і практики методу він отримав Нобелевську премію) і їм названий полярографією. Ця назва збережена в пам'ять Я.Гейровського для розділу вольтамперометрії, де індикаторний електрод – ртутний крапельній електрод.
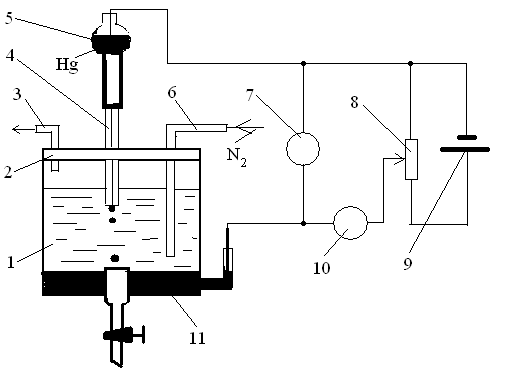
1 – полярографічна комірка; 2 – кришка; 3 – трубка для виводу азоту;
4 – капіляр; 5 – сосуд зі ртуттю; 6 – трубка для вводу азоту; 7 – вольтметр; 8 – реостат; 9 – джерело живлення; 10 – мікроамперметр; 11 – донна ртуть.
Рисунок 3.30 - Принципова схема полярографу
Зазвичай полярографічний аналіз використовують для визначення іонів металів, які електролітичне відновлюються на ртутному катоді, який має малу поверхню(капля ртуті, яка витікає з капіляру). Анодом використовується шар ртуті з великою поверхнею на дні комірки.
Класичний полярографічний аналіз виконують на спеціальному приладі – полярографі, який складається з полярографічної комірки і вимірювальної схеми. Принципова схема полярографу наведена на рисунку 3.30.
Полярографічна комірка являє собою скляний сосуд з розчином електроліту у якому розчинена речовина. У комірку підведена ртутний крапельний електрод(мікроелектрод) - капіляр 4, який за допомогою гумової трубки з’єднаний з сосудом зі ртуттю 5. При витіканні ртуть утворює висячи краплі діаметром біля 1 мм, які періодично відриваються від капіляру, завдяки чому поверхня електроду постійно оновлюється. Для видалення кисню, як електроактивної речовини, на початку аналізу розчин насичують інертним газом(азот, аргон, гелій) скрізь трубку 6. Електродом порівняння використовують донну ртуть 11, або хлорид срібний чи каломельний електроди. Індикаторними електродами у вольтамперометрії також використовують платинові, або вуглецеві матеріали(графіт, скляно вуглець).
Вимірювальна схема полярографу складається із джерела живлення 9, реостату 8, за допомогою якого змінюється потенціал індикаторного електроду. Цей потенціал вимірюється вольтметром 7, а струм - мікроамперметром 10.
Сутність полярографічного аналізу полягає в наступному.
Якщо плавно змінювати напругу на електродах і фіксувати значення струму, то при наявності у розчині полярографічно активної речовини(яка може відновлюватися на катоді), залежність струму від потенціалу катоду буде мати вигляд, зображений на рисунку 3.31.

1 – полярограма іону, що розряджається; 2 - фонового електроліту.
Рисунок 3.31 - Класична полярограма.
На відрізку аб струм змінюється у незначній мірі, цей струм звуть остатнім, який зумовлений розрядом домішок. З точки б зріст струму якби попереджує зріст потенціалу електроду – електрод деполяризується. Потенціал у точці б зветься потенціалом виділення, при цьому потенціалі починається електрохімічна реакція. На електроді зі значною поверхнею густина струму незначна і його потенціал практично залишається сталим. На мікроелектроді густина струму значна, його рівноважний потенціал змінюється, при цьому зменшується концентрація іонів у поверхні мікроелектроду Сs у зрівнянні з їх концентрацією у глибині С0. При цьому збільшується швидкість їх дифузії із розчину. Коли всі іони, що підходять з розчину, будуть миттєво розряджатися, їх концентрація на поверхні мікроелектроду стане дорівнювати нулю, і різниця Сs - С0 стане максимальною і сталою. З цього моменту(точка в) швидкість дифузії іонів і сила струму також становляться максимальними і сталими, і не залежать від потенціалу. Цей струм зветься дифузійним Іd. З подальшим збільшенням напруги почнеться розряд іншого катіону, або фонового електроліту і буде спостерігатися нове збільшення струму(точка г).
Графічне зображення поляризації електроду від напруги зветься вольт амперною кривою, полярографічною хвилею, або полярограмою.
Рух іонів може відбуватися не тільки за рахунок дифузії, але і під дією електричного поля(міграція) і за рахунок зміни густини розчину(конвекція). Для запобігання міграційного струму у розчин вводять значну кількість електроліту, який не приймає участі у електрохімічній реакції(фоновий електроліт). Він екранує електрод, зменшує міграцію іонів, що визначаються, практично до нуля. Крім того він збільшує електропровідність розчину. Рух іонів за рахунок конвекції ліквідують перемішуванням розчину.
Класичний полярографічним метод зводиться до побудови кривих залежності струму від напруги і їх аналізу. Рівняння оборотної полярографічної хвилі(якщо реакція перебігає оборотне) має вигляд:
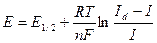 ,
,
де Е1/2 – потенціал півхвилі.
Якщо: І=1/2Іd то: 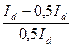 =1, і тоді Е=Е1/2. Таким чином потенціал півхвилі не залежить від струму(концентрації іонів, що розряджаються) і характеризується тільки природою речовини. Визначення Е1/2 – основа якісного полярографічного аналізу.
=1, і тоді Е=Е1/2. Таким чином потенціал півхвилі не залежить від струму(концентрації іонів, що розряджаються) і характеризується тільки природою речовини. Визначення Е1/2 – основа якісного полярографічного аналізу.
Кількісні визначення засновані на залежності дифузійного струму від концентрації визначаємого іону. Якщо підтримувати сталими умови вимірювань, то дифузійний струм пропорційний концентрації визначаємої речовини у широкому інтервалі концентрацій:
Id = кС0,
де к – коефіцієнт, який залежить від властивості електроду, природи іону і умов вимірювання. Таким чином Id визначає концентрацію іону.
Якщо у розчині міститься декілька речовин, то полярограма буде мати вигляд як на рисунку 3.32. Для фонового електроліту 0,1 М КСl потенціали півхвилі складають: E1/2Cd = -0,6B, E1/2Ni = -1,1B, E1/2Mn = -1,4B.
Сучасні варіанти вольтамперометрії різноманітні. Це осцилографічна полярографія, імпульсна, змінно-токова та інші. Приваблює метод інверсійної вольтамперометрії, який дозволяє визначати неорганічні і органічні речовини з концентрацією до 10-9 – 10-10 М. У цьому методі використовують попереднє концентрирування визначаємої речовини на поверхні індикаторного електроду. Електроліз здійснюють при потенціалі предільного струму відновлення речовини при інтенсивному перемішуванні розчину впродовж певного часу. Після цього вмикають розгортку потенціалу і реєструють полярограму виділення(окиснення визначаємої речовини).
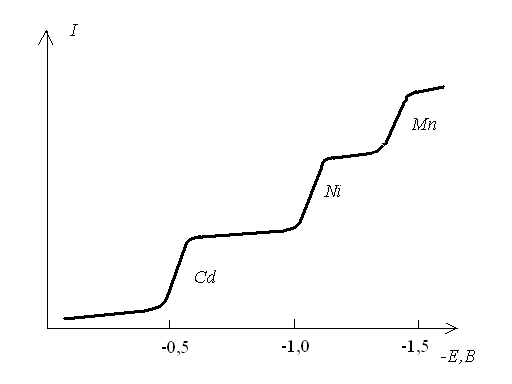
Рисунок 3.32 - Полярограма розчину який містить Cd, Ni, Mn.
Амперметричне титрування. Метод засновано на вимірюванні дифузійного струму, який змінюється при титруванні внаслідок зміни концентрації речовини. За результатами титрування будують криву амперметричного титрування, відкладаючи по вісі ординат показники гальванометру(мікроамперметру), а по вісі абсцис – об’єм титранту. Точку еквівалентності визначають по злому кривої.
Необхідною умовою амперметричного титрування є видалення зі сфери реакції продуктів взаємодії визначаємої речовини з титрантом. Для цього використовують реакції утворення малорозчинних або мало дисоційованих сполук, чи окисно-відновні реакції. Іншою умовою є наявність дифузійного струму хоча б однієї з речовин, які беруть участь у реакції: речовини, що визначається; титранту; продукту реакції; або спеціально доданої електроактивної речовини – полярографічного індикатору. В залежності від цього криві титрування мають різний вигляд.
Розглянемо криву амперметричного титрування по струму речовини, що визначається(рисунок 3.33 а). До додавання титранту концентрація визначаємої речовини максимальна і мікроамперметр показує наявність дифузійного струму. В процесі титрування визначаєма речовина видаляється з зони реакції, її концентрація, а відповідно і дифузійний струм, зменшуються. В точці еквівалентності концентрація речовини, що визначається, мінімальна, струм зменшується до мінімуму і далі залишається сталим.

а – за струмом речовини, що визначається;
б – за струмом титранту;
в – за струмом продукту;
г – за струмом визначаємої речовини і титранту.
Рисунок 3.33 - Криві амперметричного титрування.
Криві титрування по струму титранту, по струму продукту і по струму визначаємої речовини і титранту, наведені на рисунку 3.33 б, в, і г відповідно.
Самостійно опрацювати тему більш детальніше за літературою:
[1] – стор. 236-251; [2] – стор. 158-189; [4] – стор. 147-190.
1.На чому засновано полярографію?
2. Наведіть схему полярографу.
3. Які параметри полярографічної хвилі дають якісну характеристику речовини, а які кількісну?
4.Який вид має полярограма розчину, який містить декілька речовин?
5. Який вигляд мають криві вольтамперометричного титрування?
ЛІТЕРАТУРА
1.Пономарев В.Д. Аналитическая химия (в двух частях). Ч. 2. Количественный анализ. – М., Высшая школа, 1982. – 288 с.
2.Основы аналитической химии. В 2 кн. Кн. 2. Методы химического анализа. Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 2002. – 494 с.
3.Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико– химические методы анализа. – М.: Высш. шк., 1991. – 256с.
4.Крешков А.П. Основы аналитической химии. В 3 кн. Кн.3. Физико-химические (инструментальные) методы анализа. – М. Химия., 1970. – 472 с.
5.Сборник вопросов и задач по аналитической химии. Под ред. проф. В.П.Васильева. М., «Высш. школа», 1976. – 215 с.
6.Чмиленко Ф.О., Деркач Т.М. Методи атомної спектроскопії: атомно-абсорбційний спектральний аналіз: Навч. посіб. – Д.: РВВ ДНУ, 2002. – 120с.
|
|
|
Дата добавления: 2014-01-11; Просмотров: 831; Нарушение авторских прав?; Мы поможем в написании вашей работы!