
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 19
|
|
|
|
Фазовые переходы I рода. Равновесие жидкости и пара. Свойства насыщенного пара. Уравнение Клапейрона-Клаузиуса. Понятие о фазовых переходах II рода. Влажность воздуха. Особенности фазовых переходов воды и их роль в природе.
Лекция 18
Фазой называется равновесное состояние вещества, которое по своим физическим свойствам отличается от других возможных равновесных состояний этого вещества.
Если система состоит из одного однородного вещества, то она однофазная. Во многих случаях система может состоять из нескольких разных однородных частей одного и того же вещества – такая система называется многофазной.
Разными фазами являются разные агрегатные состояния вещества, например: пар, вода и лед – разные фазы воды.
Процессы, при которых вещество переходит из одной фазы в другую, при изменении внешних условий (температура, давление и т.д.) называются фазовыми переходами.
Фазовый переход жидкости в газообразное состояние называется парообразованием. Обратный переход из газообразного состояния в жидкое называется конденсацией. Парообразование происходит при испарении и кипении.
Испарением называется парообразование, которое происходит с поверхности жидкости при любой температуре. Интенсивность испарения зависит от рода жидкости, температура, площади поверхности жидкости, наличия потоков воздуха.
При испарении жидкость покидают наиболее быстрые молекулы, которые могут преодолеть силу притяжения со стороны остальных молекул жидкости. Кроме того, они должны выполнить работу против внешнего давления пара, который существует над жидкостью. Очевидно, что эта работа выполняется за счет кинетической энергии самих молекул.
Поэтому жидкость покидают самые «быстрые» молекулы. Следовательно, средняя кинетическая энергия молекул оставшихся в жидкости уменьшается, и жидкость при испарении охлаждается (спирт, эфир на коже человека). Чтобы при испарении температура жидкости не уменьшалась ей необходимо передавать некоторое количество теплоты (энергию).
Количество теплоты, которое необходимо передать единице массы жидкости для изотермического перевода ее в пар при внешнем давлении равном давлению насыщенного пара при данной температуре называется удельной теплотой парообразования.
Она зависит от рода жидкости и температуры. Процесс парообразования сильно зависит от давления, под которым находится жидкость. Пока давление насыщенного пара при данной температуре меньше внешнего, испарение происходит медленно, спокойно.
При некоторой температуре начинается бурный процесс парообразования – кипение жидкости. Оно характеризуется возникновением пузырьков пара внутри жидкости, которые увеличиваются, поднимаясь к поверхности жидкости, перемешивая ее.
Температура кипения это и есть та температура, при которой давление насыщенного пара равно внешнему давлению. Температура кипения зависит от рода жидкости, внешнего давления, наличия примесей.
Молекулы жидкости, которые покинули ее, могут вернуться обратно. Это значит, что процессы парообразования и конденсации происходят одновременно. Обратный испарению процесс конденсации сопровождается выделением теплоты, такой же, которая была затрачена на испарение.
Если количество молекул, покидающих жидкость и возвращающихся в нее за какой-то промежуток времени одинаковое, то количество жидкости и пара при данной температуре изменяться не будет. Имеет место динамическое равновесие.
Пар, который находится в динамическом равновесии со своей жидкостью, называется насыщенным паром.
В отличие от газов давление и плотность насыщенного пара не зависит от объема. Поэтому на экспериментальных изотермах Ван-дер-Ваальса наблюдаются горизонтальные участки.
При повышении температуры (при V = const) плотность насыщенного пара увеличивается, а плотность жидкости уменьшается (рис.1).
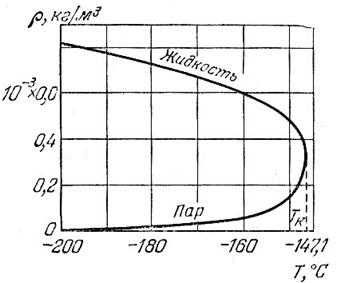
Рис.1. Зависимости плотности жидкого азота и его насыщенного пара от температуры.
Плотность жидкости и плотность насыщенного пара достигают одинакового значения при критической температуре. В этой точке у этих кривых общая касательная (вертикаль).
При повышении температуры увеличивается плотность насыщенного пара, следовательно, увеличивается и его давление (рис.2).
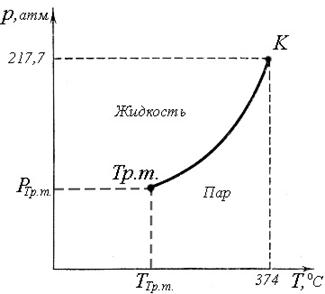
Рис.2. Зависимость давления насыщенного пара от температуры для воды
Кривая p (T) начинается в тройной точке и заканчивается в критической точке. Как видно из графика p (T) равновесие двух фаз пар – жидкость может существовать только в некотором интервале температур и давлений. Очевидно, что кривая зависимости давления насыщенного пара от температуры совпадает с кривой зависимости температуры кипения от давления. При давлении 3570 мм.рт.ст. (~5 атмосфер) вода кипит при 150 oC, а при давлении 4 мм.рт.ст. при 0 oC.
Две любые фазы вещества могут находиться в равновесии только при определенном давлении и температуре. Определим связь между этими параметрами. Рассмотрим цикл Карно для системы состоящей из двух фаз вещества, находящихся в равновесии при температуре T и давлении p, например: жидкость - насыщенный пар (рис.3):
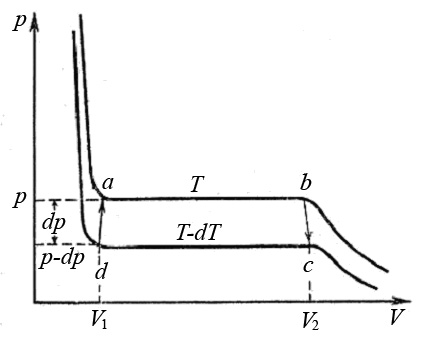
Рис.3. Цикл Карно для двухфазной системы жидкость - насыщенный пар
Изотермический процесс a – b сопровождается фазовым переходом некоторой массы жидкости m в пар. При этом переходе объем вещества увеличивается на величину ∆ V:
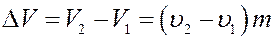 (1)
(1)
где υ 1 и υ 2 - удельные объемы жидкости и пара соответственно.
Для перехода жидкости в пар ей требуется передать количество теплоты Q 1:
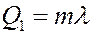 (2)
(2)
где λ – удельная теплота парообразования.
Это теплоту система получает от нагревателя с температурой T при выполнении цикла Карно. КПД цикла Карно не зависит от рода рабочего тела и определяется следующим образом:
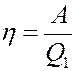 (3)
(3)
где A – работа, выполненная за цикл, Q 1 – количество теплоты, полученное от нагревателя.
Работа, выполненная за цикл равна площади фигуры abcd:
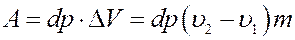 (4)
(4)
Учитывая (4) и (2) из (3) получим:
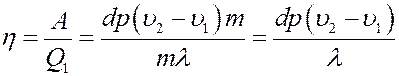 (5)
(5)
С другой стороны КПД цикла Карно:
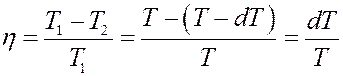 (6)
(6)
Приравняем (5) и (6):
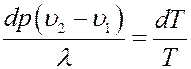
Или:
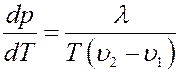 (7)
(7)
Уравнение (7) – это уравнение Клапейрона – Клаузиуса. Это уравнение справедливо для всех фазовых переходов (плавление – кристаллизация, сублимация – конденсация). Оно показывает изменение давления, при котором фазы находятся в равновесии, при изменении температуры.
Знак производной dp / dT зависит от того, каким изменением удельного объема (увеличением или уменьшением) сопровождается фазовый переход, который происходит при поглощении теплоты. При испарении жидкости или твердого тела (сублимация или возгонка) удельный объем газовой фазы всегда больше чем жидкой или твердой υ 2 > υ 1, поэтому dp / dT > 0 для кривой испарения или сублимации. Повышение температуры приводит к увеличению равновесного давления и наоборот.
Определим зависимость давления насыщенного пара от температуры. При достаточно низких температурах плотность насыщенного пара мала и он ведет себя подобно идеальному газу. Запишем уравнение Клапейрона-Менделеева для 1 моля пара:
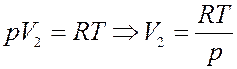 (8)
(8)
При низких температурах V 1 < V 2 т.е., объем конденсированной фазы мал по сравнению с газовой. Поэтому можно положить V 1 ≈ 0. Тогда с учетом (8) из (7) получим:
 (9)
(9)
Разделим переменные в (9):
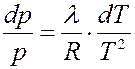 (10)
(10)
Интегрируя (10) получим:
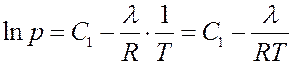 (11)
(11)
где C 1 – постоянная интегрирования.
Из (11) найдем p:
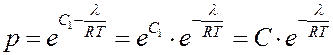 (12)
(12)
где C = 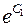 - некоторая постоянная.
- некоторая постоянная.
Из (12) следует, что давление насыщенного пара быстро возрастает с увеличением температуры.
Фазовые переходы – плавление, парообразование, сублимация и обратные им, которые происходят со скачкообразным изменением свойств вещества: внутренней энергии, энтропии, объема и других величин, – называются фазовыми переходами I рода.
При этих переходах изменяется характер упаковки частиц – дальний порядок, ближний порядок, полный беспорядок. Для фазовых переходов I рода характерно скачкообразное (в узком температурном интервале) изменение свойств вещества. Эти переходы происходят квазистатично при постоянной температуре и давлении. Поэтому можно говорить об определенной температуре фазового перехода (температура плавления, кипения и т.д.).
Однако существуют еще и фазовые переходы, при которых изменение свойств вещества происходит сразу во всем объеме в результате изменения кристаллической решетки. При этом при некоторой температуре изменяется симметрия кристаллической решетки. Эта температура и будет температурой (точкой) фазового перехода, который в данном случае называется фазовым переходом II рода.
Температура, при которой наблюдается фазовый переход II рода, называется точкой (температурой) Кюри, по имени Пьера Кюри, который открыл фазовый переход II рода в ферромагнетиках.
При таких фазовых переходах в точке перехода не будет равновесия двух фаз, потому что фазовый переход происходит одновременно во всем объеме вещества. Поэтому в точке перехода нет и скачка внутренней энергии U. Следовательно, такие переходы не сопровождаются выделением или поглощением теплоты перехода.
Однако при температурах выше и ниже точки фазового перехода вещество находится в разных кристаллических модификациях, теплоемкость которых неодинаковая.
Таким образом, в точке фазового перехода II рода скачком изменяется теплоемкость С, т.е. первая производная внутренней энергии по температуре:
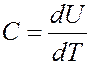
На кривой зависимости C (T) в некоторой точке при температуре равной температуре фазового перехода величина теплоемкости изменяется скачком: резко уменьшается, а затем возрастает (рис.4):
Рис.4. Лямбда – точка гелия
Форма кривой C (T) напоминает греческую букву λ, поэтому эту точку, в которой происходит фазовый переход, часто называют λ - точкой.
Примеры фазовых переходов II рода: переход ферромагнетика в парамагнетик, переход сегнетоэлектрика из полярной фазы в неполярную фазу (параэлектрическая фаза), переход жидкого гелия из состояния He I в сверхтекучее состояние He II.
При фазовых переходах II рода агрегатное состояние вещества (в отличие от фазовых переходов I рода) не изменяется.
В воздухе всегда содержится некоторое количество водяных паров. Наличие водяных паров в атмосфере имеет большое значение для жизни растений, животных и человека.
Для характеристики содержания водяных паров в воздухе вводится понятие влажности.
Количество водяного пара, находящегося в единице объема воздуха называется абсолютной влажностью.
Парциальное давление водяного пара, находящегося в воздухе называется упругостью водяного пара.
Относительной влажностью воздуха называется отношение давления водяного пара p, который находится в воздухе, к давлению насыщенного водяного пара p0 при той же температуре:
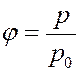
Так как давление пара (газа) пропорционально его плотности, то можно дать другое определение относительной влажности.
Относительная влажность воздуха есть отношение плотности водяного пара, находящегося в воздухе, к плотности насыщенного водяного пара при той же температуре.
Температура, при которой водяной пар, находящийся в воздухе становится насыщенным (т.е. относительная влажность становится равной 100%), называется точкой росы.
Влажность воздуха измеряется гигрометрами и психрометрами.
Вода – одна из самых интересных жидкостей. Удельная теплота парообразования воды 2,26*106 Дж/кг – одна из самых больших среди подобных величин. При конденсации пара такое же количество теплоты выделяется. Испарение воды людьми, животными, растениями требует большого количества теплоты, поэтому организмы не перегреваются. При понижении температуры водяной пар становится насыщенным, при этом выпадает роса. При конденсации пара в жидкость выделяется большое количество теплоты, и температура воздуха понижается не очень резко. При возможности заморозков растения поливают, увеличивая влажность воздуха над землей с целью защиты растений от заморозков.
Очень интересным является и другой фазовый переход: плавление льда и кристаллизация воды. Удельная теплота плавления льда одна из самых больших – 3,34*105 Дж/кг. Поэтому при переходе воды в лед выделяется очень большое количество теплоты, смягчающее климат в прибрежных районах. И, наоборот, при плавлении льда такое же количество теплоты поглощается, что приводит также к смягчению климата (так называемый морской климат, без резких колебаний температуры).
Плотность льда меньше плотности воды и лед плавает на поверхности воды. Теплопроводность льда маленькая. Плотность воды максимальна при 4oC. Поэтому глубокие водоемы не промерзают зимой до дна, что очень важно для жизнедеятельности живых организмов.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1476; Нарушение авторских прав?; Мы поможем в написании вашей работы!