
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізотерми Амага
|
|
|
|
Зокрема, закон Бойля-Маріотта задовільно описує поведінку цілого ряду реальних газів лише в обмежених інтервалах тисків (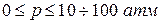 ) і при певному значенні температури - температури Бойля Т Б. При T > T Б, T < T Б для більшості багатоатомних газів, як показують експерименти, навіть в області малих тисків добуток pV залежить від тиску (pV = f (p)).
) і при певному значенні температури - температури Бойля Т Б. При T > T Б, T < T Б для більшості багатоатомних газів, як показують експерименти, навіть в області малих тисків добуток pV залежить від тиску (pV = f (p)).
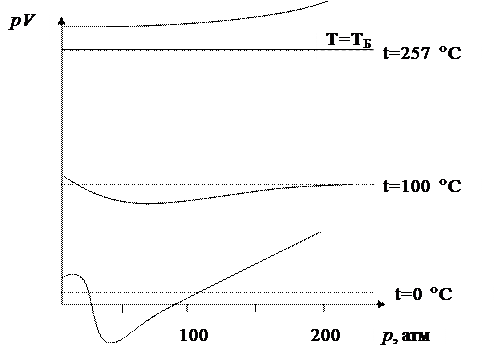 |
На рис.1 показані експериментально отримані ізотерми для вуглекислого газу в координатах pV і р при T=const - такі ізотерми називають ізотермами Амага.
Рисунок 1 - Ізотерми Амага для вуглекислого газу
Для більшості багатоатомних газів в області малих тисків (від 0 до 20-30 атм) pV зменшується зі зростанням р, а далі зростає з підвищенням р.
Проте, якщо температура реального газу дорівнюватиме певному значенню Т = Т Б (для кожного газу температура Бойля Т Б має своє значення: для водню Т Б = 673 К, для вуглекислого газу Т Б = 530 К), то ізотерми Амага будуть співпадати з ізотермами Бойля-Маріотта в деякому інтервалі тисків і не залежатимуть від тиску. При температурах Т > T Б, як правило, для багатьох газів добуток pV зі зростанням р збільшується.
Залежність 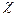 = f (p) для реального газу
= f (p) для реального газу
Коефіцієнт ізотермічної стисливості для ідеального газу 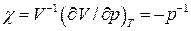 повинен змінюватися обернено пропорційно тиску. Експерименти ж показують, що для реальних газів при великих тисках c спадає з підвищенням тиску швидше, ніж обернено пропорційно до тиску; при малих же тисках навпаки газ легше стискається.
повинен змінюватися обернено пропорційно тиску. Експерименти ж показують, що для реальних газів при великих тисках c спадає з підвищенням тиску швидше, ніж обернено пропорційно до тиску; при малих же тисках навпаки газ легше стискається.
Немає нічого дивного в тому, що реальні гази значно відрізняються за властивостями від ідеальних газів. Пригадати припущення, які ми зробили для виведення рівнянь ідеальних газів: взаємодія між молекулами газу відсутня, власний об’єм молекул не враховувався.
Дослід показує, що ці обидва припущення, покладені в основу теорії ідеального газу, є наближеними. Якщо за нормальних умов (Т =273К, р =105Па) вони ще виправдані, то при тисках р >100атм сили міжмолекулярної взаємодії і об’єм самих молекул повинні враховуватися в рівняннях, що описують поведінку газу.
Приклад. Радіус молекули r ~ 10-10м  її об’єм V ~ 10-30 м3. За нормальних умов в 1м3 знаходиться n ≈ 2.7∙1025 молекул. Отже, за цих самих умов власний об’єм всіх молекул в 1м3 дорівнює
її об’єм V ~ 10-30 м3. За нормальних умов в 1м3 знаходиться n ≈ 2.7∙1025 молекул. Отже, за цих самих умов власний об’єм всіх молекул в 1м3 дорівнює
V 0 ~ 10-30∙2.7∙1025 = 2.7∙10-5(м3)
Тобто
 ,
,
об’єм молекул становить 0.01% всього об’єму. Тому ми можемо знехтувати як розмірами частинок, так і силами взаємодії між ними, якщо сили взаємодії швидко убувають із збільшенням відстані між молекулами. При р ~ 105 атм власний об’єм молекул матиме той самий порядок, що й об’єм, зайнятий газом, тобто відстань між частинками буде того самого порядку, що й самі розміри молекул, а сили взаємодії будуть помітно проявляти себе не тільки в момент зіткнень.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1162; Нарушение авторских прав?; Мы поможем в написании вашей работы!