
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Некоторые металлохромные индикаторы
|
|
|
|
эриохром черный Т
рН 6,3 – 11,6
Мурексид – индикатор на ион Са2+
Все Ме-индикаторы малоустойчивы в разных растворах, поэтому их используют либо непосредственно перед приготовлением, либо в виде смеси 1: 100 с NaCl
lgβyMeInd = 5,4; lgβyCaInd = 3,8 – условные константы (рН = 9,2)
∆рМе = 4,4 – 6,4 ∆рМе = 2,8 – 4,8
4. Кривые титрования в комплексонометрии это зависимость рМе = - lg[Me] от степени оттитрованности.
До точки стехиометричности равновесие процесса диссоциации образующегося комплекса MeY2–  Me2+ + Y4- смещено влево, т.к. в растворе присутствует избыток ионов Ме2+, концентрацией Ме2+, образующихся за счет диссоциации комплексоната, можно пренебречь.
Me2+ + Y4- смещено влево, т.к. в растворе присутствует избыток ионов Ме2+, концентрацией Ме2+, образующихся за счет диссоциации комплексоната, можно пренебречь.
Концентрацию ионов Ме2+ рассчитывают по формуле:
[Me2+] =  .
.
Допустим титруется соль СаСl2 c С(1/1СаСl2) = 0,1 моль/дм3). До начала титрования f = 0 %, [Me2+] = Сисх. и рCa = 1
Когда оттитровали 50 % 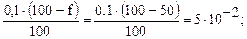 рСа = 1,3
рСа = 1,3
f = 90 % [Са2+] = 
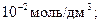 рСа = 2
рСа = 2
f = 99 % рСа = 3
f = 99,9 % рСа = 4 – точка начала скачка на кривой титрования.
В точке стехиометричности f = 100% в растворе присутствует только комплексонат кальция и устанавливается равновесие:
СаY2–  Ca2+ + Y4–.
Ca2+ + Y4–.
 βуст. =
βуст. = 

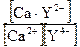 ; [Ca2+] = [Υ4-]
; [Ca2+] = [Υ4-]
 βуст. =
βуст. = 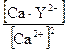 ;
; 


[Ca2+] = 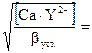

рСа = 5,5; рСа = 1/2lgβ – 1/2lg[Ca]
После точки стехиометричности [Υ4-] = С изб. комплекс.Ш (рН = 10 – все СН2СОО- депротопир.
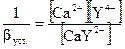 [Ca] = 0.1 м (без разбавления)
[Ca] = 0.1 м (без разбавления)
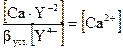 ; [Υ4-] =
; [Υ4-] = 
100,1 %
[Ca2+] = 
рСа = 7
101 %
[Ca2+] =  ;
;
рСа = 8
110 %
[Ca2+] = 10-9;
рСа = 9.
Особенностью кривых титрования является то, что их нельзя построить по экспериментальным точкам.
Выбор индикатора: 3,8±1 = 4,8-2,8
(эриохром черный)
Точка стехиометричнсти будет достигнута позже, чем индикатор изменит свою окраску, чтобы этого избегать в раствор всегда добавляют некоторое количество ионов Мg, образующих с эриохромом черным более устойчивый комплекс рМgInd = 4,4 – 6,4, поэтому изменение окраски произойдет в тот момент когда рМе = 5,2,будет минимальной.
Факторы, влияющие на скачок:
1. рКнест. ↑, ск ↑.
2. Концентрация рМе ↑ при с ↑.
3. Условий выполнения рН, to, наличии конкурирующих методов.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 576; Нарушение авторских прав?; Мы поможем в написании вашей работы!