
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение активностей и коэфф. активностей эл-тов
|
|
|
|
а) обычно – элементы без жидкостного контакта
1) элемент: 
2) реакция: 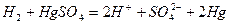
3) ур-ние Нернста:



б) случай, когда величина  неизвестна
неизвестна
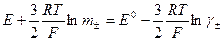 ,
, 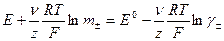


 , график
, график 


4. Определение  раствора
раствора
а) электроды, используемые для определения 
б) схема цепи: индикаторный электрод –электрод сравнения
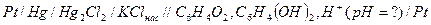
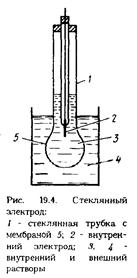
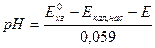
в) стеклянный электрод
1) схема стеклянного электрода,
 , стекл. шарик,
, стекл. шарик, 
2) природа возникновения потенциала – ионный обмен, т.е. обмен между ионами щелочного металла, содержащимися в стекле, и ионами водорода раствора:
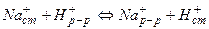
3) условная запись и потенциал электрода,



 - находят используя буферные растворы с известным значением
- находят используя буферные растворы с известным значением 
4) 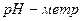 :
: 

5) линейная зависимость  выполняется для
выполняется для 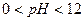 ,
,
6) достоинство - потенциал не искажается присутствием в растворах окислителей и восстановителей, электродных ядов)
5. Определение 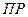 малорастворимых соединений
малорастворимых соединений
1) а) 2 подхода к электроду: 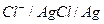 ,
, 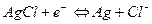
б) 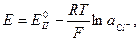
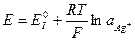

2) 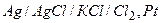
Если левый электрод рассматривать как эл-д 1-го рода, то:
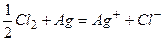
 ,
, 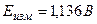
6. Потенциометрическое титрование
а) суть потенциометрического метода определения эквивалентной точки. Cнятие зависимости  .
.
 б) титрование кислоты щелочью с использованием стеклянного электрода. Характер кривой
б) титрование кислоты щелочью с использованием стеклянного электрода. Характер кривой 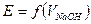 .
.
в) дифференциальная кривая титрования 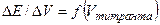
г) применение в случае мутных и окрашенных растворов
г) другие области применения метода потенциометрического титрования (осаждение, комплексообразование)
Химические источники тока
1. Любой хим. г. э. – источник электрического тока
а) гальванич. элементы. - автономные источники электропитания
б) нет мех частей, бесшумны, способны к длит. эксплуатации
б) от карм. фонариков до энергоустановок космич. кораблей
2. Первичные (одноразового действия) источники тока
Элемент Лекланше (1868): 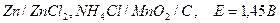
 ,
, 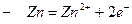
Длительность эксплуатации ограничивается - запасом активной массы отрицательного электрода
3. Вторичные источники тока – многократно используемые
а) Свинцовый кислотный аккумулятор, 
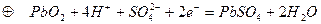
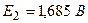
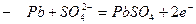




б) в процессе разряда – оба электрода покрываются 
в) Принцип работы аккумулятора: 
4. Топливные элементы
а) современные теплосиловые установки:
 ,
,  .
.
б) определение топливного эл-та как устройства, в котором химическая энергия топлива путем электрохимического окисления непосредственно преобразуется в электрическую
в) водородно-кислородный элемент,  :
:
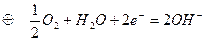
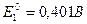




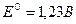 (реакция горения водорода)
(реакция горения водорода)

г) в отличие от обычных гальванических элементов восстановитель (топливо) и окислитель (кислород) не являются его составной частью, а подаются извне и энергия вырабатывается пока в него поступают топливо и окислитель. Электроды т.э. не вступают в токообразующие реакции и не расходуются в процессе работы. Ресурс работы т.э. определяется запасом топлива и окислителя и не зависит от активной массы анода.
д) недостаток – малая скорость процесса необходим электрокат ализатор!
ХИМИЧЕСКАЯ КИНЕТИКА
Введение.
1. Химическая термодинамика отвечает на вопрос о принципиальной возможности и направлении химического процесса и устанавливает возможный его результат, т.е. природу продуктов реакции и соотношение между ними по завершении процесса. Другими словами, химическая термодинамика определяет равновесное состояние, к которому стремится анализируемая система ( ).
).
2. Однако термодинамическая возможность химической реакции еще не означает, что она будет реально протекать на практике.
Пример: гремучая смесь, 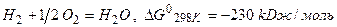 .
.
а) 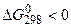 , самопроизвольный процесс
, самопроизвольный процесс
б) практическое отсутствие реакции при 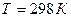 .
.
в) изменение скорости взаимодействия 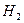 и
и  при введении катализатора (губчатой
при введении катализатора (губчатой 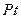 ).
).
3. Указанный пример показывает недостаточность только термодинамического подхода при изучении химических процессов. Термодинамика, оперирующая лишь сведениями о начальном и конечном состоянии системы, не в состоянии ничего сказать о фактической реализуемости термодинамически возможного процесса, т.е. о том как быстро, за какое время он будет осуществлен.
4. Вопросами скоростей занимается раздел Химическая кинетика.
Химическая кинетика – наука о скоростях химических превращений, факторах, определяющих эти скорости, и механизме протекания реакций.
5. Содержание раздела “Химическая кинетика”.
1) формальная кинетика,
2) теории кинетики,
3) цепные и фотохимические реакции,
4) реакции в растворах
5) гетерогенная кинетика,
6) катализ
ФОРМАЛЬНАЯ КИНЕТИКА
Определение.
Формальная кинетика – раздел химической кинетики, занимающийся формальным количественным (макроскопическим) описанием скоростей химических превращений на основе экспериментальных данных без рассмотрения механизма протекающих процессов.
Основные понятия химической кинетики.
1. Скорость химической реакции.
а) Определение – изменение количества реагирующего вещества
в единицу времени в единице объема:  .
.
б) 
в) скорость р-ции, определенная по разным реагентам, различна 
г) Общий случай, 
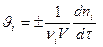

 , т.к.
, т.к. 
2. Основной постулат химической кинетики.
а) Определение: 

б) Константа скорости (удельная скорость) реакции, 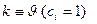 .
.
3. Порядок реакции.
а) Частные 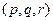 и общий порядки
и общий порядки  реакции.
реакции.
б) Порядок реакции и стехиометрические коэффициенты,
Общий случай: 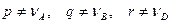
в) Численные значения порядка реакции.
4. Молекулярность реакции.
а) Определение. Число частиц, принимающих участие в элементарном акте химического взаимодействия. Элементарный акт хим. взаимодействия ( ) – непосредственное превращение исходных веществ в продукты реакции в одну стадию.
) – непосредственное превращение исходных веществ в продукты реакции в одну стадию.
б) Численные значения молекулярности реакции.
5. Различие понятий порядок и молекулярность реакции.
а) молекулярность – вполне определенный физический смысл, порядок, порядок – формальное понятие
б) понятие молекулярности неприменимо к сложным реакциям
в) целые значения для молекулярности, любые – для порядка.
Классификация химических реакций
1. По природе частиц, принимающих участие в химическом акте
(молекулярные, ионные, радикальные и т.д.). Основные типы частиц: молекулы, атомы, ионы, радикалы, комплексные частицы.
2. По обратимости
а) Обратимые (двусторонние):  ,
,  .
.
б) Необратимые (односторонние):  ,
,  .
.
3. По механизму протекания реакции: простые (одностадийные) и
сложные (многостадийные с участием промежуточных частиц).
4. В зависимости от фазового состава реакционной смеси.
а) Гомогенные ( и гетерогенные
и гетерогенные 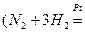

б) Гомофазные 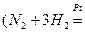
 и гетерофазные
и гетерофазные 
5. Кинетическая классификация на основании понятий
а) порядка реакции 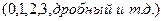 .
.
б) молекулярности 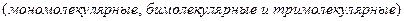 .
.
Кинетика простых необратимых реакций
Различают два способа осуществления химического процесса: в стационарных условиях и в потоке. В первом случае реакция проводится в замкнутой системе, когда все реагирующие вещества от начала и до окончания реакции остаются в пределах рассматриваемой системы. В этом случае отсутствует материальный обмен с окружающей средой.
В случае реакций в потоке исходные вещества непрерывно поступают в реактор, а продукты уводятся из сферы реакции. Такие системы получили название открытых систем.
Ниже мы рассмотрим кинетику формально простых гомогенных газофазных реакций в замкнутых системах.
Необратимые реакции Iго порядка
1. 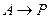 ,
, 
2. Вывод уравнения  , размерность
, размерность 
3. Анализ уравнения.
а) зависимость 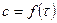
1) аналитическая зависимость 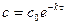 ,
, 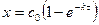
2) график 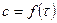 :
:  , кинетическая кривая
, кинетическая кривая
б) графическая линейная зависимость 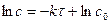 ,
, 
в) период полупревращения 
4. Среднее время жизни реагирующей частицы 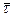 .
.
а) 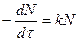 ,
, 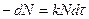
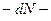 уменьшение числа молекул в промежутке от
уменьшение числа молекул в промежутке от 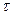 до
до  и, таким образом,
и, таким образом, 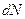 равно числу молекул, «доживших» до момента времени
равно числу молекул, «доживших» до момента времени 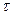 и распавшихся в последующий б/малый промежуток времени
и распавшихся в последующий б/малый промежуток времени 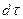 . Умножая
. Умножая 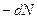 на
на 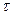 , найдем суммарную продолжительность жизни этих молекул. Тогда для всех молекул получаем
, найдем суммарную продолжительность жизни этих молекул. Тогда для всех молекул получаем 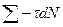 , где
, где 
Но 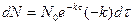 , и тогда
, и тогда 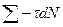
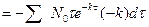
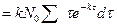
б) Все молекулы прореагируют за б/большой промежуток времени. Поэтому суммарную продолжительность жизни всех первоначально взятых молекул можно найти интегрируя правую часть последнего выражения от 0 до 
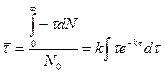
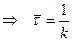
5. К реакциям 1го порядка относятся реакции разложения, например, термический распад паров ацетона:  и процессы радиоактивного распада.
и процессы радиоактивного распада.
Необратимые реакции 2го порядка: 
1. Случай (а): 

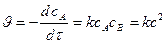
1) Вывод уравнения 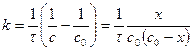 ,
, 
2) Зависимость 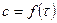 :
: 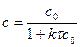

3) Графическая линейная зависимость 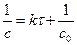 ,
, 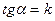
4) Период полупревращения, 
5) Псевдомолекулярные реакции (гидролиз сложных эфиров),
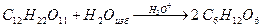
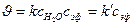
2. Случай (б): 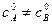

а) 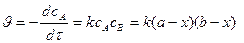 , где
, где  ,
, 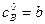
б) 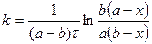 ,
, 
Необратимые реакции 3го порядка
1. 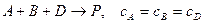 :
: 
2.  ,
, 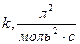

3. Линейная зависимость: 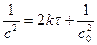 ,
, 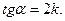
4. Период полупревращения, 
5. 


Необратимые реакции нулевого порядка
1. 
2. Вывод уравнения:  ,
, 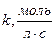


3. Зависимость 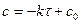 , график
, график
Необратимые реакции nго порядка
1. 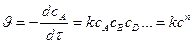 ,
, 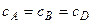
2. Вывод уравнения 

 .
.
Реакции дробного порядка
1. Пример: 
3. Механизм реакции: 
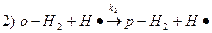
3. Скорость реакции: 

Методы измерения скоростей химических реакций
1. Суть метода 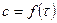 :
: 
2. Химические и физико-химические аналитические методы
а) химические методы определения концентраций реагентов
1) прямой (непосредственный) метод,
2) необходимость быстрого анализа – “торможение в пробе”
(“замораживание”, удаление катализатора, разбавление),
б) физико-химические методы (спектральные, электрохимич.,
хроматографические и т.д.)
1) основаны на регистрации какого-либо физ-хим свойства, которое пропорционально концентрации данного реагента. И далее по калибровочному графику свойство – концент-рация, полученному заранее, определяют концентрацию
2) достоинство – быстрое измерение
3) пример - по давлению реакционной смеси 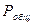
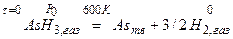


Методы определения порядка реакции
1. Метод изолирования Оствальда (метод избытка) – общий подход
а) суть – определение частных порядков по каждому веществу при
практическом постоянстве концентраций других реагентов
б) 
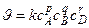
1) определение порядка реакции по реагенту 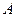 :
:

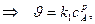 где
где 
2) аналогично определяют порядки по 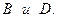
3) общий порядок: 
2. Интегральные методы определения порядка реакции
а) метод подбора уравнений
1) аналитический – суть метода состоит в подстановке  реа-гирующего в-ва для различных моментов времени от начала р-ции в кинетические ур-ния различных порядков (1го, 2го, 3го и т.д). Искомым является тот порядок, для которого наблюдается постоянство (неизменность) значения константы скорости реакции при различных концентрациях
реа-гирующего в-ва для различных моментов времени от начала р-ции в кинетические ур-ния различных порядков (1го, 2го, 3го и т.д). Искомым является тот порядок, для которого наблюдается постоянство (неизменность) значения константы скорости реакции при различных концентрациях
2) графический – состоит в нахождении такой функции концентрации от продолжительности реакции, которая имела бы линейный характер:
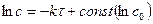 ,
,
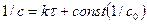 ,
,
 ,
, 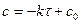 .
.
б) метод Оствальда-Нойеса – использует зависимость 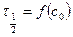 :
:
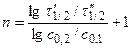
3. Дифференциальные методы Вант-Гоффа
а) Аналитический метод – по двум значениям 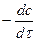 при двух
при двух 
1) по одной кинетической кривой - 
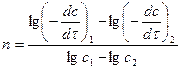
2) по 2ум начальным концентрациям - 
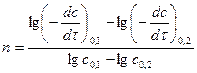
3) по значениям средних скоростей
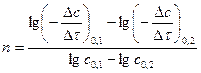
б) Графический вариант метода Вант-Гоффа
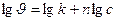 ,
, 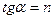 .
.
Сложные реакции
Введение.
1. Сложные реакции – многостадийные химические процессы, включающие ряд послеловательно и (или) параллельно протекающих химических превращений.
2. Принцип независимости (сосуществования) отдельных стадий
а) В основе кинетического изучения сложных реакций лежит принцип независимости протекания элементарных реакций – постулат химической кинетики.
Согласно ему, если в системе одновременно протекают несколько элементарных химических реакций, то каждая из них идет независимо от остальных, а скорость ее прямо пропорциональна концентрациям реагирующих веществ, т.е. подчиняется основному постулату хим. кинетики.
б) Конечное изменение концентрации данного вещества является результатом всех независимо протекающих элементарных реакций, в которых оно принимает участие, неважно как: как исходное вещество или как продукт реакции.
в) Данный принцип является всеобъемлющим. Сопоставление опытных данных с теоретическими уравнениями для обратимых, последовательных и других реакций показывает справедливость этого принципа.
3. Типы сложных реакций.
а) обратимые (двусторонние), б) параллельные, в) последователь-
ные (консекутивные), г) сопряженные
Обратимые реакции 1го порядка.
1.  ,
, 
2. Скорость реакции.
а)  ,
,
б)  ,
,
в)  .
.
3. Вывод уравнения 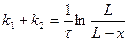 .
.
4. 2ое уравнение – константа равновесия  .
.
5. Смысл 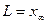 ,
, 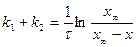
6. Определение  и
и  из системы 2ух уравнений.
из системы 2ух уравнений.
7. Кинетические кривые 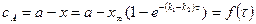 и
и  .
.
 |
Графическое представление для случая
 , т.е. когда концент-рация продукта при равновесии < конц-ции исходного вещества
, т.е. когда концент-рация продукта при равновесии < конц-ции исходного вещества
Параллельные реакции
1. Понятие – реакции, в ходе которых одни и те же исходные вещества одновременно реагируют в двух или более направлениях с образованием различных продуктов.
2.  Пример:
Пример: 
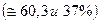
3. Скорость реакции
а) 
б) 
в) 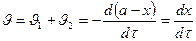 , где
, где 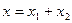

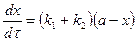
4. Вывод уравнения 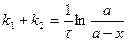
5. 2ое уравнение:  или
или 
 постоянство состава
постоянство состава
продуктов в любой момент времени течения реакции.
6. Скорость процесса в целом определяется наиболее быстрой из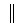 реакций. Пусть
реакций. Пусть 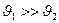


7. Кинетические кривые 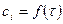 для всех реагентов,
для всех реагентов, 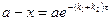 .
.
Графическая интерпретация.
Последовательные реакции
1. Определение – реакции, протекающие через ряд последовательных стадий с образованием более или менее устойчивых промежуточных веществ (гидролиз этилового эфира янтарной кислоты)
2. Общая схема: 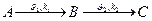
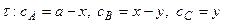
3. Скорость реакции по каждому реагенту
а) 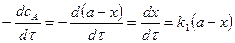
б) 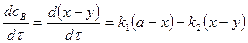
в) 
4. Решение уравнений
а)  ,
, 
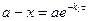 ,
, 
б) 


в) 
5.
 |
Графическая интерпретация кривых
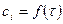 для реагентов
для реагентов 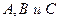 .
.
Вещество А
6. Зависимость для вещества А:

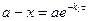 - падает по экспоненте
- падает по экспоненте
Вещество В
7. Время достижения максимальной концентрации вещества 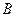 :
:
а)  ,
,
б) 
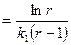 , где
, где 
в)  , если
, если  , то с
, то с 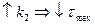
т.е., чем больше  при данном
при данном  тем скорее достигается максимальная концентрация промежуточного вещества B
тем скорее достигается максимальная концентрация промежуточного вещества B
8. Максимальный выход вещества 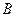 :
:

но  ,
,
Тогда

Далее 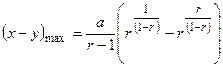
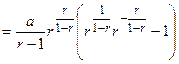
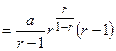
Окончательно

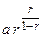
9. Анализ уравнения п.8.
а) 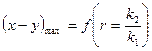 ,
,

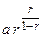
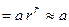
 промежуточное вещество В устойчиво
промежуточное вещество В устойчиво
б) 
 промежуточное вещество В неустойчиво
промежуточное вещество В неустойчиво
Вещество С
10. S-образная форма кривой продукта реакции 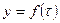
1) 
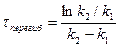 , т.е.
, т.е. 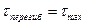
2) индукционный период 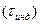 - время разгона реакции
- время разгона реакции
Принцип лимитирующей стадии химического процесса
1. Предельные случаи протекания последовательной реакции
а) 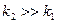

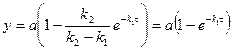
б) 

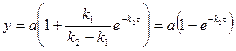
2. Лимитирующая стадия последовательной реакции
а) Скорость процесса - функция скоростей всех стадий реакции
б) В случае резкого различия скоростей последовательных стадий
скорость реакции в целом определяется скоростью наиболее медленной стадии – лимитирующей (скорость-определяющей).
Характер зависимостей 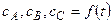
Вещество А
1. Зависимость для вещества А

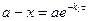 - падает по экспоненте
- падает по экспоненте
Вещество В
2. Время достижения максимальной концентрации вещества 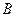 :
:
а)  ,
,
б) 
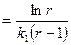 , где
, где 
в)  , если
, если  , то с
, то с 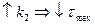
т.е., чем больше  при данном
при данном  тем скорее достигается максимальная концентрация промежуточного вещества B
тем скорее достигается максимальная концентрация промежуточного вещества B
3. Максимальный выход вещества 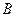 :
:
а) 
но  , тогда
, тогда 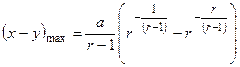
Далее 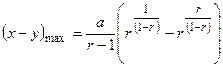
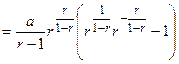
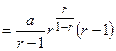
Окончательно

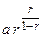
4. Анализ уравнения
а) 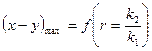 ,
,

б) 
т.о. чем больше  , тем выше ордината максимума
, тем выше ордината максимума
Вещество С
5. S-образная форма кривой продукта реакции 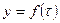

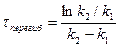 , т.е.
, т.е. 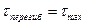
6. Индукционный период 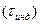 - время разгона реакции
- время разгона реакции
Принцип лимитирующей стадии химического процесса
1. Предельные случаи протекания последовательной реакции
а) 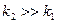

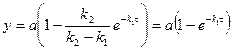
б) 

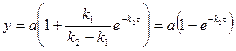
2. Лимитирующая стадия последовательной реакции
а) Скорость процесса - функция скоростей всех стадий реакции
б) В случае резкого различия скоростей последовательных стадий
скорость реакции в целом определяется скоростью наиболее медленной стадии – лимитирующей (скорость-определяющей).
Метод стационарных (квазистационарных) концентраций
1. Суть метода
Метод предложен немецким ученым Боденштейном и развит Н.Н.Семеновым.
Метод применим к последовательным реакциям, если промежуточные продукты являются частицами с высокой реакционной способностью (атомы, радикалы, валентно-ненасыщенные молекулы).
1. В таких процессах по прошествии некоторого времени от начала реакции устанавливается такой характер течения процесса, когда скорость образования промежуточных активных частиц оказывается примерно равной скорости их расходования 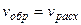 . Тогда концентрация этих активных частиц поддерживается практически неизменной на протяжении всего процесса (
. Тогда концентрация этих активных частиц поддерживается практически неизменной на протяжении всего процесса ( ), а устанавливаюшийся при этом режим протекания реакции наз. стационарным. Отсюда и название метода.
), а устанавливаюшийся при этом режим протекания реакции наз. стационарным. Отсюда и название метода.
В стационарном режиме скорость изменения концентрации активных промежуточных частиц, очевидно, равна нулю:
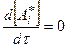
2. Метод, предложенный Боденштейном, дает возможность существенно упростить кинетический анализ сложных реакций.
a) В результирующие кинетические уравнения для скорости реакции часто входят концентрации
активных промежуточных веществ, экспериментальное нахождение концентраций которых весьма
непросто в связи с малым временем жизни этих частиц (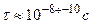 ).
).
б) Метод стационарных концентраций позволяет используя простые алгебраические уравнения выразить концентрации активных промежуточных веществ через концентрации устойчивых реагентов (исходных веществ или продуктов реакции), что позволяет составлять кинетические уравнения, не содержащие концентраций активных промежуточных частиц.
в) Применение метода будет рассмотрено в дальнейшем.
Зависимость скорости химической реакции от температуры
Зависимость  определяется влиянием температуры на константу скорости реакции
определяется влиянием температуры на константу скорости реакции
1. Скорость реакции, 
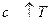 .
.
2. Анализ уравнения 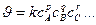 ,
, 
3. Зависимость 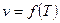

Правило Вант-Гоффа
1. Приближенное правило – температурный коэфф Вант-Гоффа (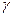 )
)

2. Вывод уравнения 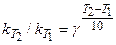 .
.
а) 
б) 
 ;
; 
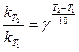
3. Приближенный характер зависимости 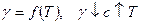 .
.
Уравнение Аррениуса
1. Формальное обоснование
а) 

 ;
;
б)  ,
, 
в) Аррениус показал, что 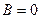 , Откуда
, Откуда  .
.
Физический смысл энергии активации
1. Представление об энергетическом барьере химической реакции.
а) энергии исходных  и конечных
и конечных  веществ,
веществ, 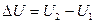 .
.
 б) Энергетическая диаграмма химической реакции
б) Энергетическая диаграмма химической реакции
Преодаление энергетич. барьера требует затраты энергии  .
.
Обратный переход -  .
.
в) 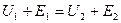

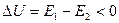
2. Определение
а) Энергия активации – некоторое избыточное количество энергии, которой должны обладать молекулы исходного вещества в расчете на 1 моль (по сравнению со средней энергией), чтобы при столкновении эти молекулы вступили в хим. взаимодействие
б) 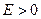
в) Энергия активации - функция природы реагирующих частиц.
1) валентнонасыщенные молекулы 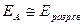
 сотни
сотни 
2) рекомбинация атомов и радикалов - 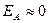
3) валентнонасыщенные + ненасыщенные 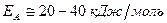
Экспериментальные методы расчета энергии активации
1. 
2. Анализ уравнения Аррениуса,  ,
, 
3. Аналитический метод
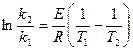

4. Графический метод, 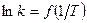
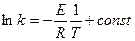 ,
,
 , т.к.
, т.к. 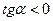
5. Экспоненциальная форма уравнения Аррениуса

6. Эффективная энергия активации
а) четкий смысл для элементарных процессов,
б)  ,
, 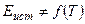 и
и 
Тримолекулярные реакции
Падение скорости тримолекулярных реакций с ростом т-ры
1. 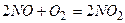 ,
, 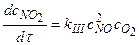

2. Схема Траутца:
 ,
,
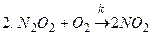
3. 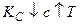 >
> 
 .
.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 1495; Нарушение авторских прав?; Мы поможем в написании вашей работы!