
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активных столкновений
|
|
|
|
Теоретические представления химической кинетики
Основная задача теорий химической кинетики - предложить способ расчета константы скорости элементарной реакции и ее зависимости от температуры, используя различные модельные представления о строении реагентов и пути реакции.
Рассмотрим два простейших теоретических подхода к трактовке элементарного акта химического превращения:
- теория активных столкновений (разработанная Алексеевым и Хиншельвудом) для бимолекулярных газовых реакций и основанная на молекулярно-кинетической теории газов
- теория активированного комплекса, разработанная на основе достижений квантовой химии и статистической термодинамики Эйрингом и Поляни.
В этой теории скорость бимолекулярной реакции связывают с числом столкновений реагирующих частиц в единице времени в единице объема.
Столкновения приводят к реакции если:
1. поступательная энергия относительного движения частиц превышает энергию активации
2. частицы правильно ориентированы в пространстве относительно друг друга.
Выражение для константы скорости бимолекулярной реакции по ТАС имеет вид:
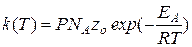
Это уравнение Траутца-Льюиса.
В этом уравнении:
Р – стерический множитель, учитывающий необходимость правильной ориентации частиц в момент столкновения;
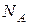 - постоянная Авогадро;
- постоянная Авогадро;
 - частота столкновений, определяемая формулой
- частота столкновений, определяемая формулой

Это вероятность столкновения двух заданных частиц, радиусами  , мольными массами
, мольными массами  в единицу времени в единице объема.
в единицу времени в единице объема.
Величина  называется сечением столкновения.
называется сечением столкновения.
Множитель 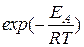 представляет собой вероятность того, что при столкновении энергия относительного поступательного движения частиц превысит энергию активации.
представляет собой вероятность того, что при столкновении энергия относительного поступательного движения частиц превысит энергию активации.
В теории активных столкновений можно рассчитать величину предэкспоненциального множителя в уравнении Аррениуса. При этом скорость реакции считают равной числу соударений (можно вычислить физическими методами) и используют экспериментально определенную энергию активации.
Для многих реакций наблюдается хорошее совпадение скорости реакции рассчитанной по ТАС (с использованием экспериментальной энергии активации) с экспериментально определенной.
Но в реакциях, протекающих в растворах, (даже для мономолекулярных реакций) между расчетными и экспериментальными величинами имеются большие расхождения. Чтобы привести теорию и эксперимент в соответствие вводят искусственно так называемый стерический фактор (или стерический множитель или фактор вероятности), который учитывает ориентацию молекул в пространстве в момент столкновения по отношению друг к другу. Стерический фактор определяется временем сближения молекул, полярностью связей внутри молекул и наличием нескомпенсированных электрических зарядов. Стерический фактор, как показано в теории активированного комплекса зависит от энтропии активации. С ростом энтропии активации увеличивается стерический фактор, а следовательно и вероятность образования активированного комплекса.
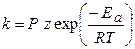 Р - стерический фактор
Р - стерический фактор
Причем для мономолекулярных реакций его величина равна 105, а для бимолекулярных 10-3 – 10-6, то есть наблюдается очень большое различие в значениях.
Из предыдущих формул видно, то температурная зависимость константы скорости имеет вид:
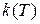 ~
~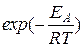 Согласно ТАС предэкспоненциальный множитель слабо зависит от температуры. Опытная или аррениусовская энергия активации, определяемая по уравнению
Согласно ТАС предэкспоненциальный множитель слабо зависит от температуры. Опытная или аррениусовская энергия активации, определяемая по уравнению
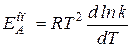
она связана с истинной энергией активации следующей формулой
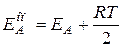
Теория активированного комплекса
Суть этой теории состоит в том, что каждый элементарный акт химического превращения протекает через переходное состояние (активированный комплекс), который характеризуется частичным ослаблением отдельных связей в исходных молекулах и частичным образованием новых связей, характерных для продуктов реакции.
В этой теории анализируется движение ядер по поверхности потенциальной энергии системы реагирующих частиц с использованием либо классических либо квантово-механических уравнений движения.
Одномерную кривую, характеризующую путь с наименьшей энергией, по которому происходит реакция, называют координатой реакции.
Сечение поверхности потенциальной энергии вдоль этой кривой дает профиль потенциальной энергии для реакции на котором имеется максимум. Все конфигурации ядер, соответствующие малой области вблизи этого максимума, называют активированным комплексом или переходным состоянием.
На большом расстоянии исходных реагентов атомов друг от друга потенциальная энергия системы равна сумме потенциальных энергий изолированных молекул АВ и D. Когда молекулы начинают сближаться электронные орбитали атомов в молекуле АВ начинают взаимодействовать, перекрываться с электронными орбиталями в молекуле D. При этом расстояние между А и В в молекуле АВ начинает увеличиваться, связь между А и В ослабевать, в то время, как связь между В и D, начинает усиливаться. Представим сказанное схемой:



Исходные реагенты активированный комплекс конечные продукты

В некоторый момент реакции энергия такой конфигурации, такой составной молекулы, называемой активированным комплексом, будет иметь максимальное значение. Пара реагирующих веществ сближена и искажена в такой степени, что малейшее искажение в дальнейшем ведет к образованию продуктов реакции. Эта критическая конфигурация называется также переходным состоянием.
Потенциальная энергия системы зависит от расстояния между атомами (А и В в начале превращения) и В и D в конце превращения и от угла, под которым атом D подходит к лини связи в молекуле АВ.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 6224; Нарушение авторских прав?; Мы поможем в написании вашей работы!